олова галогениды
ОЛОВА ГАЛОГЕНИДЫ
Известны простые ди- и тетра-галогениды SnX2 и SnX4 (см. табл.), смешанные галогениды 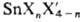 , оксогалогениды, а также комплексные — галогено-станнаты. 8пCl4 — бесцветная жидкость, остальные — кристаллы; хлориды и фториды Sn, а также SnBr4 бесцветны. Тетра-галогениды — кислоты Льюиса, по силе их можно расположить в ряд SnCl4 " SnBr4 > SnI4. Наиб. практич. значение имеют хлориды Sn.
, оксогалогениды, а также комплексные — галогено-станнаты. 8пCl4 — бесцветная жидкость, остальные — кристаллы; хлориды и фториды Sn, а также SnBr4 бесцветны. Тетра-галогениды — кислоты Льюиса, по силе их можно расположить в ряд SnCl4 " SnBr4 > SnI4. Наиб. практич. значение имеют хлориды Sn.
Тетрахлорид SnCl4 дымит на воздухе вследствие гидролиза; tкрит 318,7 °C, pкрит 3,7 МПа; уравнение температурной зависимости давления пара: lg р(Па) = 12,87-1925/T (298–388 К). Хорошо смешивается с водой, при этом объем раствора заметно меньше суммы объемов компонентов. Из горячих конц. водных растворов при охлаждении до 83–63 °C выделяется тригидрат, при 63–56 °C-тетрагидрат, при 56–19 °C-пентагидрат, ниже 19 °C-октагидрат. Разб. растворы SnCl4 гидролизуются, в растворах образуется также H2 [SnCl6].
СВОЙСТВА ГАЛОГЕНИДОВ ОЛОВА
таблица в процессе добавления
* Температура возгонки. ** Плотн. α-SnF2 5,33 г/см3.
Тетрахлорид раств. в этаноле, диэтиловом эфире и некоторых др. органических растворителях; растворяет S, Р, галогены; с Cl2 дает эвтектику при −106 °C, содержащую 86% хлора. Хлориды Fe, Al, Ta, Nb частично раств. в SnCl4. Тетрахлорид — окислитель; склонен к реакциям присоединения, легко образует комплексные соед. с HCl, NH3, PCl5. Так, из смеси растворов SnCl4 и NH4Cl кристаллизуется гексахлоростаннат (NH4)2 [SnCl6], который возгоняется при 400 °C. Гексахлоро-станнаты щелочных металлов разлагаются выше 600 °C. Известны аддукты SnCl4∙NO, 3SnCl4∙2PH3, продукты присоединения спиртов, орг. сульфидов, аром, соед., эфиров и др. Получают SnCl4 взаимод. Sn с Cl2 (сильноэкзотермич. реакция). Применяют для получения Sn и оловоорг. соед., как катализатор полимеризации и др. реакций, протраву при крашении тканей, для утяжеления натурального шелка, как компонент светочувствит. бумаги, для отделения Rb и Cs от К в аналит. химии.
Дихлорид SnCl2 в парах при 600–700 °C димерен; уравнение температурной зависимости давления пара lg р (Па) = = 12,73-4480/T (677–902 К); растворимость в воде 83,8 г в 100 г при 0 °C. Из водного раствора кристаллизуется дигидрат, в разб. водных растворах гидролизуется. В присут. небольших количеств HCl растворимость SnCl2 в воде уменьшается, но при высокой кислотности повышается. SnCl2 хорошо раств. в этаноле, диэтиловом эфире, ацетоне, пиридине и др. органических растворителях; растворы SnCl2 — сильные восстановители. Хлор окисляет SnCl2 до SnCl4, O2-до оксохлорида. С аммиаком SnCl2 образует аммиакаты SnCl2∙nNH3 (n = 1, 4, 9), с хлоридами металлов-комплексные соед., напр. K[Sn2Cl5] (т. пл. 218 °C), К [SnCl3] (т. пл. 255 °C), Sn [Al2Cl8] (т. пл. 209 °C), Sn [A1C15] (т. пл. 158,5СС), Sn[Ta2Cl12] (т. пл. 239 °C). Получают SnCl2 взаимод. Sn с Cl2, HCl или хлоридами др. металлов. Применяют как катализатор полимеризации эпоксидов, восстановитель в орг. синтезе, протраву при крашении тканей, для обработки поверхности стекла и пластмасс перед металлизацией для повышения адгезии, как компонент флюса при сварке, для получения Sn, как реагент для определения Cl2, I,, Hg2+, Fe3+ и др., для обесцвечивания нефтяных масел. Тетрафторид SnF4 хорошо раств. в холодной воде, не раств. в большинстве орг. растворителей, раств. в горячем ТГФ. Образует гексафторостаннаты щелочных металлов M2[SnF6], а также (NH4)4 [SnF8], K3H[SnF8] и др. Получают SnF4 либо фторированием SnCl4, либо прямым взаимод. Sn и F2. Дифторид SnF2 кристаллизуется в ромбич. (a) и моноклинной (b) модификациях, хорошо раств. в воде, этаноле, диэтиловом эфире, практически не раств. в CHCl3; с фторидами щелочных металлов и аммония образует соед. М [SnF3], известен также Na [Sn2F5]; получают взаимод. SnO с газообразным HF. Применяют как компонент зубных паст, флюсов для пайки, твердых электролитов и электролитов для лужения.
Тетрабромид SnBr4 и тетраиодид SnI4 получают взаимод. Sn соотв. с Br2 и I2. Из водного раствора при обычной температуре SnBr4 кристаллизуется в виде тетрагидрата. Гексабро-мооловянная кислота H2 [SnBr6]∙8H2O — бесцв. расплывающиеся на воздухе кристаллы; известны гексабромостаннаты (IV) М2 [SnBr6]. Тетраиодид образует сильно светопреломляю-щие кристаллы, окрашенные от желтого до желто-коричневого цвета; раств. в CS2, этаноле, диэтиловом эфире, бензоле и др. органических растворителях; гидролизуется водой, поэтому иодостаннаты нельзя получить из водного раствора. Дибромид SnBr2-желтые кристаллы; хорошо раств. в воде, в растворах гидролизуется. Дииодид SnI2-оранжево-красные кристаллы, слабо раств. в воде. SnI2 и SnBr2 раств. в метаноле; по химическим свойствам сходны с SnCl2 и образуют аналогичные комплексные соединения.
Получены смешанные галогениды: SnBr3Cl (т. пл. 1,0 °C, т. кип. 73 °C, плотн. 3,12 г/см3), SnBrCl3 (т. пл. −1,0 °C, т. кип. 50 °C, плотн. 2,51 г/см3) и др.
Лит.: Фурман А. А., Неорганические хлориды (Химия и технология), М., 1980. См. также лит. при ст. олово.
Н. П. Дергачева
