олефинов тиооксиды
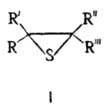
ОЛЕФИНОВ ТИООКСИДЫ (тиираны, алкиленсульфиды, a-тиооксиды)
соед. общей формулы I, где R — R''' = Н, Alk, Ar. Называют О. т. как производные простейшего О. т. — тиирана (этиленсульфида, в формуле I R-R''' = H) или по назв. соответствующего олефина, напр. метилтииран, или пропилен-сульфид.
Соед., содержащие О. т., встречаются в природе, напр. входят в состав эфирного масла хмеля.
О. т. — бесцв. (или светло-желтые) жидкости с неприятным запахом или низкоплавкие кристаллы; хорошо раств. во мн. органических растворителях (ограниченно — в низших спиртах), не раств. в воде. При нагр. выше 100–200 °C разлагаются.
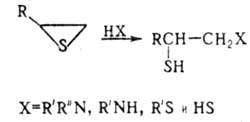
Под действием нуклеоф. агентов О. т. обычно региоспе-цифично или региоселективно раскрывают цикл по связи С—S у наиб. гидрогенизир. атома углерода (по правилу Красуского), напр.:
Реакции с алкоголятами и аллил- или бензилгалогенидами приводят к  -алкоксисульфидам:
-алкоксисульфидам:
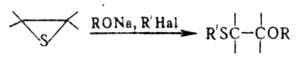
Взаимод. с некоторыми CH-кислотами в присутствии оснований протекает с расширением цикла, напр.:
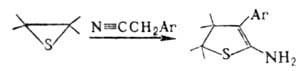
Аналогично происходит реакция с CS2, COS, ксантогенатами, изотиоцианатами, напр.:
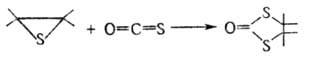
К этому типу реакций относится тииран-тиетановая перегруппировка α-галогеналкилзамещенных О. т. при реакциях с О- и S-нуклеофилами:
. 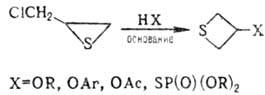
Региоселективность раскрытия цикла О. т. электрофилами ниже, чем нуклеофилами. При взаимодействии с HCl и HBr в безводных средах и конц. водных растворах О. т. превращаются в
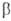 — галогеналкантиолы. Реакции с HI приводят к бис-(2-галогеналкил)дисульфидам. С HHal в растворах ангидридов кислот О. т. превращаются в S-
— галогеналкантиолы. Реакции с HI приводят к бис-(2-галогеналкил)дисульфидам. С HHal в растворах ангидридов кислот О. т. превращаются в S-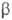 -галогеналкиловые эфиры тиолкарбоновых кислот:
-галогеналкиловые эфиры тиолкарбоновых кислот:
Аналогично протекает взаимод. с галогенидами Р(Ш) и As(III) в присутствии ZnCl2.
Хлор и бром в безводных средах энергично раскрывают цикл О. т. с образованием b-галогеналкилсульфенилгалогенидов, а при избытке О. т.-бис-( -галогеналкил)сульфидов; аналогично протекают реакции с хлоридами серы, алкил-, арил- и ацилсульфенилхлоридами, напр.:
-галогеналкил)сульфидов; аналогично протекают реакции с хлоридами серы, алкил-, арил- и ацилсульфенилхлоридами, напр.:
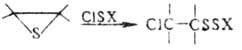
Алкил(реже арил)тиираны под действием гидридов металлов Li, Si, Sn или орг. соед. Li, Mg раскрывают цикл с образованием вторичных сульфидов, напр.:
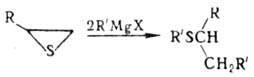
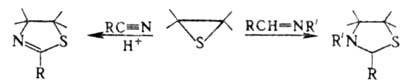
В присут. электрофилов или при нагр. О. т. вступают в реакции с непредельными соед.: с нитрилами в присутствии сильных кислот или кислот Льюиса образуют тиазолины, с азометинами и гидразонами — тиазолидины, напр.:
При нагр. в присутствии катализаторов (бронза, комплексы некоторых металлов), восстановлении, а также при взаимодействии с фосфинами и фосфитами, тиокетенами (при УФ облучении), предшественниками карбенов или нитренов (напр., оксази-ридинами) О. т. десульфуризуются с образованием олефинов и серосодержащих соед., напр.:
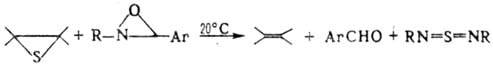
Реакции осуществляются стереоспецифично.
О. т. легко полимеризуются в условиях катионной и анионной полимеризации; сополимеризуются между собой, а также с акриловыми мономерами, алкилвиниловыми эфирами, олефинами и 1,3-диенами. Наиб. часто полимеризацию проводят в растворах; катализатор — производные Zn или Cd, сокатализаторы — спирты, H2S, тиолы и дитиолы, амины, алкиленамины, NH3 .
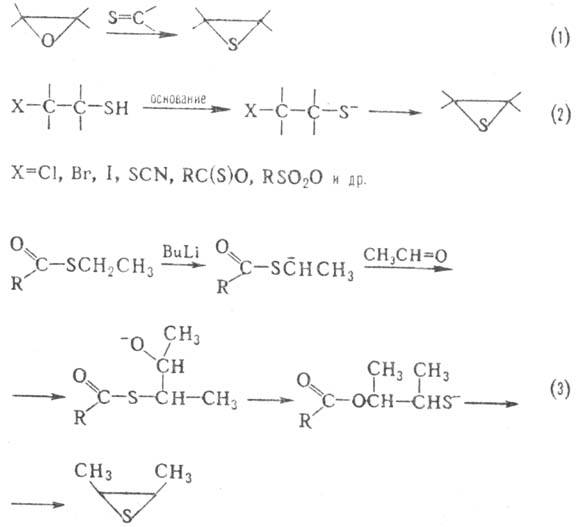
Осн. методы синтеза О. т.: замещение атома О оксиранов на атом S (тиолирование), осуществляемое действием KSCN, тиомочевины, тионов (реакция 1); внутримол. конденсация р-замещенных тиолат-анионов (2 и 3); взаимод. тионов с диазоалканами (4); присоединение атомарной серы к олефинам (5):
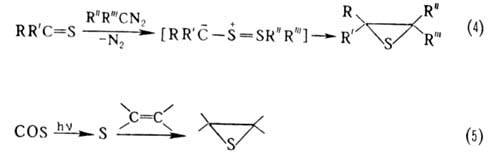
О. т. используют в синтезе лекарственных средств, пестицидов, термостойких полимеров, антиоксидантов, модифицирующих добавок для кожезаменителей, резин, натуральных и синтетич. волокон. Низшие О. т. рекомендованы для одорации газов.
О. т. мало- или среднетоксичны для теплокровных; токсичность возрастает с увеличением мол. массы О. т.
Лит.: Фокин А. В., Коломиец А. Ф., Химия тииранов, М., 1978; Фокин А. В., Аллахвердиев М. А., Коломиец А. Ф., "Успехи химии", 1990. т. 59, в. 5, с. 705–737; Zoller U., в кн.: The chemistry of heterocyclic compounds, v. 42, pt 1, ed. by A. Hassner, N.Y., 1983, p. 330–630.
А. Ф. Коломиец
