нитроны
НИТРОНЫ
N-оксиды азометинов, соед. общей формулы 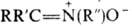 . Различают альдонитроны (R-H, R' и R:-орг. радикалы) и кетонитроны (R, R', R: — орг. радикалы). По номенклатуре ИЮПАК Н. называют, добавляя слово "оксид" к назв. алкилиденамина, напр.
. Различают альдонитроны (R-H, R' и R:-орг. радикалы) и кетонитроны (R, R', R: — орг. радикалы). По номенклатуре ИЮПАК Н. называют, добавляя слово "оксид" к назв. алкилиденамина, напр.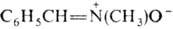 N-бензилиденметиламин-N-оксид. Н. изомерны сазиридинам (изонитронам).
N-бензилиденметиламин-N-оксид. Н. изомерны сазиридинам (изонитронам).
Н., как правило, кристаллич. вещества. ИК спектр имеет характеристич. полосу при 1550–1620 см−1 (C=N), в УФ спектрах несопряженных Н. lмакс 240 нм (lge ~ 4), в спектре ПМР альдонитронов хим. сдвиг (d) ~ 7 м. д. (a-Н), в спектре ЯМР 13С хим. сдвиг a-С-атома ~ 142 м. д.
Электронное строение Н. может быть представлено резонансными структурами:
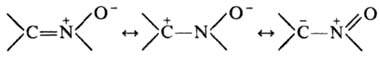
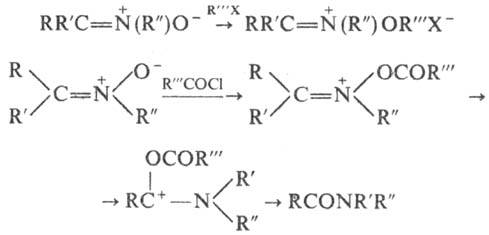
Н. — слабые основания, при действии кислот протонируются по атому О с образованием непрочных солей. Алкилирование и ацилирование также происходят по атому О; ацили-рование обычно сопровождается перегруппировкой, приводящей к амидам:
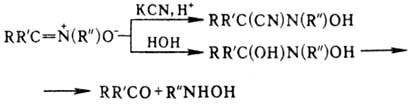
Н. вступают в реакции 1,3-присоединения с нуклеофилами, образуя производные М,М-дизамещенных гидроксиламина; при гидролизе образуются карбонильные соед. и гидроксиламины:
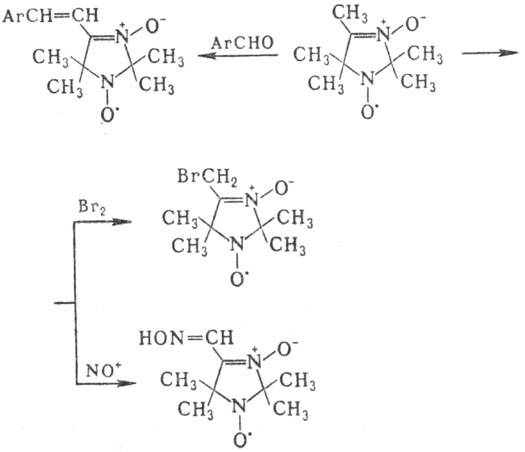
Атомы водорода С-алкильных групп обладают кислыми свойствами: легко обмениваются на дейтерий, галоген, нитро-зогруппу, вступают в конденсацию типа альдольной, напр.:
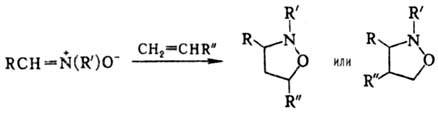
Н. легко вступают в реакции диполярного [3 + 2]-цикло-присоединения с алкенами, диенами и др. Альдонитроны, особенно в случае цис-расположения атомов Н и О, более реакционноспособны, чем кетонитроны. Реакции позволяют получать с высокими выходами разл. гетероциклич. соед., напр.:
Под действием сильных оснований Н. претерпевают 1,3-прототропный сдвиг:
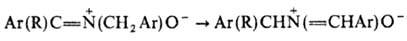
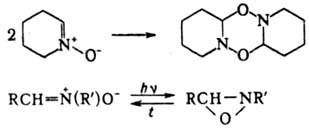
Некоторые Н. легко дают циклич. димеры; при УФ облучении изомеризуются в оксазиридины, при нагр. происходит обратная реакция:
Н. устойчивы к действию большинства окислителей. Водный раствор периодата окисляет альдонитроны до N-гидрокси-амидов. Восстановление Н. комплексными гидридами металлов приводит к N,N-дизамещенным гидроксиламина, а при каталитич. восстановлении образуются азометины и вторичные амины:
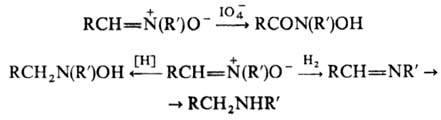
Н. реагируют со своб. радикалами с образованием нитро-ксильных радикалов, что используют в методе спиновых ловушек:
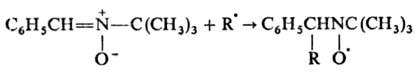
Осн. методы синтеза Н.: 1) конденсация карбонильных соед. с N-замещенными гидроксиламина:
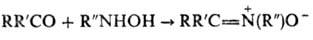
2) алкилирование оксимов алкилгалогенидами или непредельными карбонильными соед., напр.:
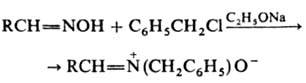
3) конденсация нитрозоароматич. соед. с бензилгалогени-дами или N-метиленпиридиниевыми солями:
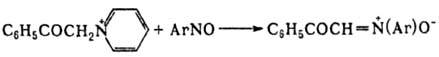
4) окисление N,N-дизамещенного гидроксиламина:
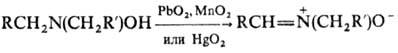
Благодаря доступности и многообразию превращений Н. широко применяются для синтеза сложных прир. веществ, стабильных нитроксильных радикалов и в изучении механизмов реакций.
Лит.: Общая органическая химия, пер. с англ., т. 3, М,, 1982, с. 613–18; Имидазолиновые нитроксильные радикалы, Новосиб., 1988; Breuer Eli, The chemistry of functional groups, ed. by S. Patai, pt 1, 1982.
Л. Б. Володарский
