нитроксильные радикалы
НИТРОКСИЛЬНЫЕ РАДИКАЛЫ (аминилоксидные, иминоксильные, аминоксильные, азотокисные радикалы)
содержат нитроксильную группу 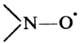 Наиб. изучены органические Н.р. общей формулы RR'NO∙, где R, R'-opr. остаток. Известны также неорганические Н.р., напр. соль Фреми (NaOSO2)2NO∙. В зависимости от числа нитроксильных групп различают моно-, би-, ..., полирадикалы.
Наиб. изучены органические Н.р. общей формулы RR'NO∙, где R, R'-opr. остаток. Известны также неорганические Н.р., напр. соль Фреми (NaOSO2)2NO∙. В зависимости от числа нитроксильных групп различают моно-, би-, ..., полирадикалы.
Называют Н.р., добавляя к систематич. назв. соед. окончание "оксил". Например, соед. формулы I (везде черточками обозначены группы CH3)-2,2,6,6-тетраметилпиперидин-1-оксил. Используют также др. способ наименования-добавляют окончание "нитроксил" к назв. заместителей R и R', напр. (трет-C4H9)2NO∙-ди-трет-бутилнитроксил, (C6H5)2NO∙-дифенилнитроксил.
Нитроксильная группа содержит трехэлектронную связь N—О; ее строение м. б. изображено резонансными формулами:
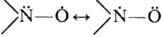
Неспаренный электрон находится на разрыхляющей p*-орбитали, образованной из 2pz-орбиталей атомов N и О. Гибридизация связей атома N близка к sp2. В ди-трет-алкилнитроксилах неспаренный электрон почти полностью локализован на группе N—О, причем спиновые плотности r на атомах N и О приблизительно равны. Замена алкильного заместителя на ароматический значительно понижает rN, в то время как rO изменяется мало. Длина связи N—О в Н.р. 0,123–0,13 нм.
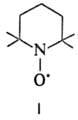
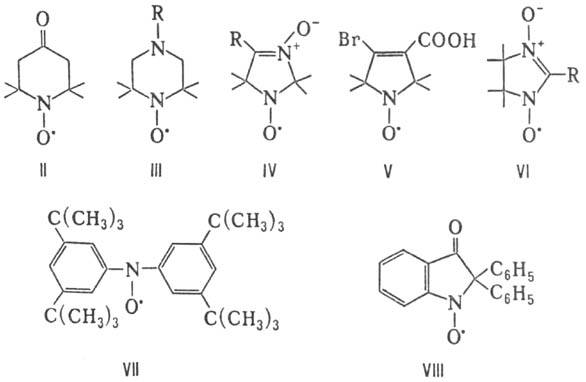
Большое количество Н.р. выделено в индивидуальном состоянии. Для них характерно наличие стерич. затруднений вблизи радикального центра — гл. обр. третичных атомов С, обрамляющих нитроксильную группу. Стабильные Н. р. — полярные (для соед. I μ 10,6∙10−30 Кл∙м) окрашенные твердые вещества или жидкости, лишь бис-(трифторметил) нитроксил (CF3)2NO∙ — газ при нормальных условиях. Примеры стабильных Н.р.-соед. I-VIII.
Некоторые Н.р. (напр., соль Фреми) в твердом состоянии-диамагн. димеры.
В ИК спектрах нитроксилов колебания группы NO проявляются в области 1340–1370 см−1. Для масс-спектров, как правило, характерно наличие интенсивного пика мол. иона М+. Интенсивность пиков ионов [М+1]+ превышает интенсивность пика изотопного иона. В спектрах ЭПР Н.р. проявляется триплетное расщепление, обусловленное сверхтонким взаимод. (СТВ) неспаренного электрона с ядром атома 14N. Константа СТВ aN зависит от строения радикала и характеризуется след. значениями (мТ):

* Квинтетное расщепление.
g-Фактор большинства Н.р. составляет 2,005–2,006.
Стабильность Н.р. определяется степенью делокализации неспаренного электрона по связям заместителей и стерич. затруднениями вблизи атомов с высокой спиновой плотностью. Мн. ди-трет-алкилнитроксилы хранятся годами без разложения. Диалкилнитроксилы, имеющие a-Н-атомы, быстро диспропорционируют:
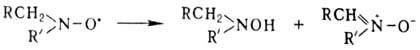
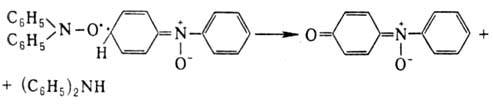
Разложение диарил- и алкиларилнитроксилов обычно включает стадию бимол. атаки нитроксильной группой по орто-или nара-положению, напр.:
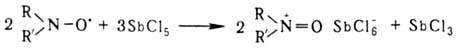
Потенциал окисления стабильных Н.р. довольно высок; они окисляются в оксоаммониевые соли только такими сильными окислителями, как Cl2, SbCl5, SnCl4, напр.:
Н. р. — очень слабые основания, напр.: для соед. I рKа —5,5. В кислых средах они находятся в равновесии с катион-радикалами 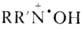 и продуктами их одноэлектронного диспропорционирования:
и продуктами их одноэлектронного диспропорционирования:
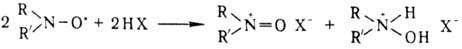
Кислоты Льюиса, напр. AlCl3, образуют с Н.р. парамагн. комплексы донорно-акцепторного типа.
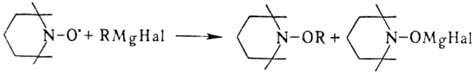
Восстановление Н.р. приводит к зависимости от природы восстановителя к соответствующим гидроксиламинам RR'NOH или аминам RR'NH. Щелочные металлы реагируют с Н.р. лишь при повышенной температуре. Взаимод. с металлоорг. соед. протекает легко, напр.:
При повыш. температуре Н.р. реагируют с углеводородами по схеме:
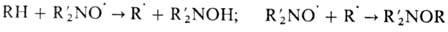
На способности стабильных Н.р. взаимодействовать с активными алкильными (но не пероксильными) радикалами основано их ингибирующее действие на цепные радикальные процессы.
На примере стабильных Н.р. были обнаружены т. наз. реакции без затрагивания своб. валентности, напр.:
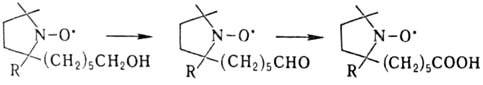
С помощью подобных реакций было синтезировано большое число Н.р. На их использовании основан метод спиновых меток (см. спинового зонда метод).
Др. важные методы получения Н.р. включают окисление (окислители PbO2, Ag2O, MnO2 и др.) N,N-диза-мещенных гидроксиламина; окисление вторичных и третичных аминов (чаще всего используют H2O2 в присутствии вольфрамата Na); восстановление нитросоед., напр.: 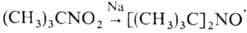 ; присоединение активных радикалов к нитрозосоед. и нитронам, напр.:
; присоединение активных радикалов к нитрозосоед. и нитронам, напр.:
Последнюю реакцию применяют в спиновых ловушек методе.
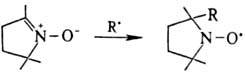
Н. р. используют в научных исследованиях для изучения механизмов хим. реакций, как спиновые метки и зонды, парамагн. модели в биофизике и медицине, стабилизаторы полимеров и др.
Лит.: Бучаченко А.Л., Вассерман A.M., Стабильные радикалы, М., 1973; Розанцев Э. Г., Шолле В. Д., Органическая химия свободных радикалов, М., 1979; Нитроксильные радикалы. Синтез, химия, приложения, М., 1987; Имидазо-линовые нитроксильные радикалы, Новосиб., 1988.
В. Д. Шолле
