муравьиная кислота
МУРАВЬИНАЯ КИСЛОТА (метановая кислота) HCOOH
мол. м. 46,03; бесцветная жидкость с резким запахом; т. пл. 8,4 °C, т. кип. 100,7 °C; d204 1,220; nD20 1,3714; h 1,784 мПа∙с (25 °C); g 37,58 мН/м; давление пара безводной М. к. (кПа): 4,40 (20 °C), 10,98 (40 °C), 25,23 (60 °C), 52,94 (80 °C); ΔH0пл 12,69 кДж/моль, ΔH0исп 46,3 кДж/моль, S0298 129 Дж/(моль∙K); C0 98,78 Дж/(моль∙К) (17 °C); e 56,1 (25 °C); μ 4,7∙10−30 Кл∙м; рKа 3,45 (25 °C). Смешивается во всех соотношениях с водой, диэтиловым эфиром, этанолом, не раств. в али-фатич. углеводородах, умеренно раств. в бензоле, толуоле, CCl4, образует азеотропную смесь с водой (т. кип. 107,3 °C; 77,5% по массе М.к.).
Молекула М.к. имеет плоское строение. Длины связей С—Н, C=O, C—O и O—H равны соотв. 0,1085, 0,1245, 0,1312 и 0,095 нм; углы О—C=O, Н—C=O и C—O—Н соотв. 124,3, 117,8 и 107,8°.
Остаток М. к. — формил, соли и эфиры-формиаты.
М. к. — простейшая карбоновая кислота, заметно сильнее др. алифатич. кислот. Вступает в реакции окисления — восстановления, присоединения, циклизации.
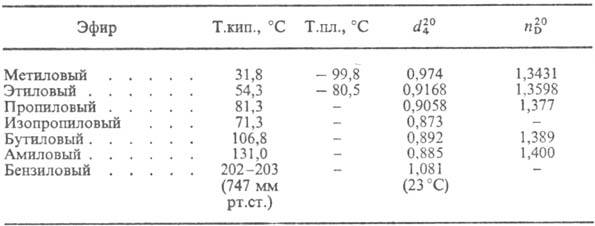
При нагревании М. к. разлагается с образованием CO2 и H2; H2SO4 расщепляет ее на CO и H2O; H2O2 окисляет до надмуравьиной кислоты НСОООН. Со спиртами в присутствии H2SO4 дает сложные эфиры (см. табл.). Подобно альдегидам М.к. проявляет восстановит. свойства: осаждает серебро из аммиачных растворов AgNO3; вступает в реакцию восстановит. аминирования, в частности в Лейкарта-Валлаха реакцию; при взаимодействии первичных и вторичных аминов с М.к. и формальдегидом образуются N-метилированные амины; смесь М.к. со стехиометрич. количеством третичных аминов-эффективный восстановитель карбонильных соед. до спиртов.
М.к. легко присоединяется к олефинам с образованием сложных эфиров; в присутствии H2SO4 олефины карбоксили-руются до третичных карбоновых кислот (реакции Коха — Хаафа), напр.:
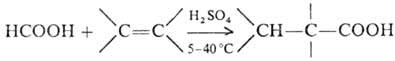
Реакция М.к. с олефинами в присутствии H2O2 и кислотных катализаторов приводит к гликолевым эфирам, а реакции с ацетиленом в паровой фазе — к виниловому эфиру. М.к. вступает в реакции циклизации, образуя с о-фенилендиамином бензимидазол, с 4,5-диаминопиримидином-пурин.
СВОЙСТВА ЭФИРОВ МУРАВЬИНОЙ КИСЛОТЫ
В природе М.к. обнаружена в хвое, крапиве, фруктах, едких выделениях пчел и муравьев (в последних впервые обнаружена в 17 в., отсюда назв.).
В больших количествах М. к. образуется в качестве побочного продукта при жидкофазном окислении бутана и легкой бензиновой фракции в производстве уксусной кислоты. М.к. получают также (~ 35% от общего мирового производства) гидролизом формамида; процесс состоит из неск. стадий: карбо-нилирование метанола, взаимод. метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию CO в присутствии щелочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию CH3OH в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет пром. значения).
М.к. применяют как протраву при крашении и отделке текстиля и бумаги, обработке кожи; как консервант при силосовании зеленой массы, фруктовых соков, а также для дезинфекции бочек для пива и вина; для борьбы с клещами, вызывающими варрооз пчел; для получения лекарственных средств, пестицидов, растворителей (напр., диметилформамида), солей и эфиров. Метилформиат-растворитель жиров, минер. и растит. масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида и др. Этил-формиат — растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла; применяют в производстве витаминов B1, A, E. Изоамилформиат — растворитель смол и нитроцеллюлозы; бензилформиат — растворитель лаков, красителей, душистых веществ.
М. к. раздражает верх. дыхат. пути и слизистые оболочки глаз; при попадании на кожу вызывает хим. ожоги.
Для М.к., метил- и этилформиата соотв. т. всп. 60, —21, −20 °C; т. самовоспл. 504, 456, 440 °C; КПВ 14,3–33,0, 5,5–21,8, 2,8–16%; ПДК 1, 100, 100 мг/м3.
Температура хранения М.к. не ниже 0 °C; при комнатной температуре медленно разлагается на CO и H2O; для хранения при температуре до 35 °C М.к. стабилизируют добавлением до 1% воды, а при 35–55 °C-до 3% воды. Объем мирового производства М.К.-250 тыс. т/год (1980).
Лит.: Физико-химические свойства продуктов производства изопрена, под ред. С.К. Огородникова, М., 1974; Агуйло А., Хорленко Т., "Нефть, газ и нефтехимия за рубежом", 1980, № 11^, с. 104–13.
Н. Г. Вергунова
Значения в других словарях
- Муравьиная кислота — Простейшая одноосновная карбоновая кислота (См. Карбоновые кислоты), HCOOH; бесцветная легкоподвижная жидкость с резким запахом; tпл 8,25 °С, tkип 100,7 °C, плотность 1,2126 г/см3 (20 °C). М. Большая советская энциклопедия
- муравьиная кислота — НСООН, монокарбоновая к-та. В свободном виде содержится в крапиве, хвое, в выделениях Муравьёв, пчёл. В форме слолшых эфиров обнаружена в нек-рых плодах (напр., яблоках). Отрицательно заряженный ион М. Биологический энциклопедический словарь
- МУРАВЬИНАЯ КИСЛОТА — МУРАВЬИНАЯ КИСЛОТА, см. метановая кислота. Научно-технический словарь
- МУРАВЬИНАЯ КИСЛОТА — МУРАВЬИНАЯ КИСЛОТА — HCOOH, жидкость с резким запахом, tкип 100,8 °С. Содержится в хвое, крапиве, едких выделениях муравьев и пчел. Получают как побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана. Большой энциклопедический словарь
- Муравьиная кислота — (acidum formicicum, Ameisensäure, acide formique), по нов. хим. номенклатуре — "метановая кислота", простейшая из органических кислот. Энциклопедический словарь Брокгауза и Ефрона
