мультиплетность
МУЛЬТИПЛЕТНОСТЬ (от лат. multiplex — многократный)
число квантовых состояний молекулы, различающихся только ориентацией суммарного электронного спина. Для мол. систем, в которых спин-орбитальное взаимодействие пренебрежимо мало, состояния с разл. ориентацией спина имеют одинаковую энергию; в этом случае М. — кратность вырождения энергетического уровня, обусловленная спином. Вырождение снимается под действием магн. поля, что отражается в спектрах как появление групп спектральных линий (мульти-плетов), в которых расстояние между линиями существенно меньше, чем расстояние между группами. Снятие вырождения в магн. поле используется для эксперим. изучения частиц с ненулевым спином методом ЭПР.
М. определяется квантовым числом S для квадрата электронного спина молекулы: 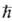 2S(S+1) (
2S(S+1) (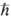 -постоянная Планка). Состоянию с данным S отвечают 2S + 1 значение проекции спина на ось, т. е. М.
-постоянная Планка). Состоянию с данным S отвечают 2S + 1 значение проекции спина на ось, т. е. М. 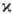 =2S+1. Поскольку спин электрона полуцелый, то
=2S+1. Поскольку спин электрона полуцелый, то 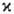 -натуральное число, причем для N-электронной молекулы с четным N возможные значения М. равны 1, 3, 5,...; соответствующие состояния наз. син-глетными, т р и п л е т н ы м и, к в и н т е т н ы м и и т. д. При нечетных N
-натуральное число, причем для N-электронной молекулы с четным N возможные значения М. равны 1, 3, 5,...; соответствующие состояния наз. син-глетными, т р и п л е т н ы м и, к в и н т е т н ы м и и т. д. При нечетных N 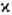 принимает значения 2, 4, 6,... (д у б л е т н ы е, к в а р т е т н ы е, с е к с т е т н ы е и т. д. состояния); во всех случаях
принимает значения 2, 4, 6,... (д у б л е т н ы е, к в а р т е т н ы е, с е к с т е т н ы е и т. д. состояния); во всех случаях 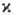 ≤ N + 1. При обозначении электронных состояний молекулы М. указывается слева вверху от букв. обозначения состояния. Так, осн. (низшее по энергии) состояние ОН∙-дублетное p-состояние обозначается как 2П (см. возбужденные состояния).
≤ N + 1. При обозначении электронных состояний молекулы М. указывается слева вверху от букв. обозначения состояния. Так, осн. (низшее по энергии) состояние ОН∙-дублетное p-состояние обозначается как 2П (см. возбужденные состояния).
Как правило, для осн. состояний молекул М. мала (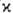 =1, 2 или 3). В рамках теории мол. орбиталей это связывают с тем, что в соответствии с Паули принципом низшие по энергии одноэлектронные уровни (мол. орбитали) заняты двумя электронами и дают нулевой вклад в суммарный спин. Состояниям с
=1, 2 или 3). В рамках теории мол. орбиталей это связывают с тем, что в соответствии с Паули принципом низшие по энергии одноэлектронные уровни (мол. орбитали) заняты двумя электронами и дают нулевой вклад в суммарный спин. Состояниям с 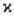 > 1 отвечают лишь частично заполненные электронные оболочки. В этом случае относит. положение по энергии состояний с одной и той же электронной конфигурацией определяется правилом Хунда: энергия убывает с ростом М. (см. хунда правила). Наиб. высокие значения М. для осн. состояний наблюдаются в соед. РЗЭ и лантаноидов; напр., для GdO в осн. состоянии М. равна 9.
> 1 отвечают лишь частично заполненные электронные оболочки. В этом случае относит. положение по энергии состояний с одной и той же электронной конфигурацией определяется правилом Хунда: энергия убывает с ростом М. (см. хунда правила). Наиб. высокие значения М. для осн. состояний наблюдаются в соед. РЗЭ и лантаноидов; напр., для GdO в осн. состоянии М. равна 9.
М. состояния-важная характеристика хим. поведения частицы, о чем свидетельствует, напр., существенно разное поведение синглетного и триплетного карбена :C2. Молекулы в дублетных осн. состояниях называют радикалами, в триплетных-бирадикалами. Считается, что молекулы в не-синглетных состояниях обладают повыш. реакц. способностью из-за частичной заполненности электронных оболочек (имеют неспаренные электроны). Однако это не всегда справедливо (напр., молекула O2-бирадикал).
М. используют для классификации квантовых переходов: переходы между состояниями с разной М. наз. интерк о м б и н а ц и о н н ы м и; если спин-орбитальное взаимод. слабо, такие переходы маловероятны (см. квантовые переходы).
Анализ тонкой структуры спектра атомов и молекул требует учета спин-орбитального и др. взаимодействий. Например, у атома с орбитальным (угловым) моментом количества движения L и спином S состояния с разными значениями суммарного момента I = L + S из-за спин-орбитального взаимод. различаются по энергии (т. наз. мультиплетное расщепление). Число таких состояний наз. мультиплет-ностью терма; оно равно |L + S| — |L— S| + 1 и совпадает с 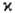 =2S + 1 лишь если L >= S. При L = 0 М. терма, по определению, считается равной 2S + 1. Мультиплетное расщепление при сильном спин-орбитальном взаимод. м. б. столь заметным, что близкими по энергии оказываются состояния с разл. спином. В подобных случаях, типичных для атомов и соед. тяжелых элементов, классификация состояний по спину (а значит, и по М.) теряет значение. При этом требуется изменить набор квантовых чисел, характеризующих молекулу или атом.
=2S + 1 лишь если L >= S. При L = 0 М. терма, по определению, считается равной 2S + 1. Мультиплетное расщепление при сильном спин-орбитальном взаимод. м. б. столь заметным, что близкими по энергии оказываются состояния с разл. спином. В подобных случаях, типичных для атомов и соед. тяжелых элементов, классификация состояний по спину (а значит, и по М.) теряет значение. При этом требуется изменить набор квантовых чисел, характеризующих молекулу или атом.
Лит. см. при ст. спин.
В. И. Пупышев
Значения в других словарях
- Мультиплетность — (от лат. multiplex — многократный) число возможных ориентаций в пространстве полного Спина атома или молекулы. Согласно квантовой механике, М. χ = 2S + 1, где S — спиновое квантовое число (См. Квантовые числа). Большая советская энциклопедия
- мультиплетность — орф. мультиплетность, -и Орфографический словарь Лопатина
- МУЛЬТИПЛЕТНОСТЬ — МУЛЬТИПЛЕТНОСТЬ — число возможных ориентаций в пространстве спина атома или молекулы. Мультиплетность определяет число подуровней, на которое может расщепляться уровень энергии вследствие спин-орбитального взаимодействия. Большой энциклопедический словарь
