молекулярные интегралы
МОЛЕКУЛЯРНЫЕ ИНТЕГРАЛЫ в квантовой химии
название интегральных выражений (интегралов), которые используются для записи в матричной форме электронного уравнения Шрёдингера, определяющего электронные волновые функции многоэлектронной молекулы (мол. системы). Подынтегральными функциями в М. и. являются атомные или мол. орбитали (волновые функции) отдельных электронов либо орбитали, преобразованные теми операторами, которые входят в оператор Гамильтона и соответствуют определенным физ. величинам (напр., потенциалу взаимод. электронов, дипольному моменту и др.). Интегрирование производят по всему объему, в котором вероятность обнаружения каждого электрона, определяемая интегралом по этому объему от произведения его волновой функции j на комплексно-сопряженную величину j*, равна 1. М. и. обычно имеют следующий вид:
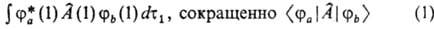
(т. наз. о д н о э л е к т р о н н ы е и н т е г р а л ы) либо
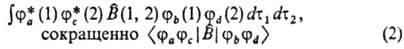
(т. наз. д в у х э л е к т р о н н ы е и н т е г р а л ы). В этих выражениях ja(1), jb(1), jс(2) и jd (2) — атомные или мол. орбитали, зависящие от переменных первого (1) или второго (2) электрона, dt1 и dt2-элементы объема для этих электронов, 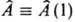 — одноэлектронный, а
— одноэлектронный, а 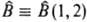 — двухэлектронный операторы, которые зависят от переменных соотв. одного или двух электронов и действуют на волновые функции jb(1) и jb(1)jd(2) (см. квантовая механика).
— двухэлектронный операторы, которые зависят от переменных соотв. одного или двух электронов и действуют на волновые функции jb(1) и jb(1)jd(2) (см. квантовая механика).
Классификация одно- и двухэлектронных М. и. связана с видом подынтегральных функций и операторов. Так, в простейшем случае, когда 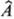 -единичный оператор (умножение на единицу), т. е., по существу, в интеграле (1) оператор отсутствует, получающийся одноэлектронный М. и. называют и н т е г р а л о м п е р е к р ы в а н и я орбиталей jа(1) и jb(1). По значению интегралов перекрывания атомных орбиталей часто судят о прочности хим. связи между атомами А и В, если ja(1) и jb(1)- атомные орбитали, соответствующие этим атомам. Если
-единичный оператор (умножение на единицу), т. е., по существу, в интеграле (1) оператор отсутствует, получающийся одноэлектронный М. и. называют и н т е г р а л о м п е р е к р ы в а н и я орбиталей jа(1) и jb(1). По значению интегралов перекрывания атомных орбиталей часто судят о прочности хим. связи между атомами А и В, если ja(1) и jb(1)- атомные орбитали, соответствующие этим атомам. Если 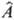 = — Zce2/R1c-oпepaтор потенциальной энергии взаимод. электрона 1 и ядра С, заряд которого Zc (R1c-расстояние между электроном 1 и ядром С), соответствующий М. и. называют интегралом электрон-я д е р н о г о в з а и м о д е й с т в и я. К числу одноэлектронных М. и. относят также интегралы кинетич. энергии, интегралы дипольного момента и др.
= — Zce2/R1c-oпepaтор потенциальной энергии взаимод. электрона 1 и ядра С, заряд которого Zc (R1c-расстояние между электроном 1 и ядром С), соответствующий М. и. называют интегралом электрон-я д е р н о г о в з а и м о д е й с т в и я. К числу одноэлектронных М. и. относят также интегралы кинетич. энергии, интегралы дипольного момента и др.
В выражениях для двухэлектронных М. и. наиб. часто встречается оператор кулоновского отталкивания электронов 1 и 2, т. е. 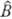 (1, 2) = е2/r12, где r12-расстояние между электронами. При этом М. и. вида
(1, 2) = е2/r12, где r12-расстояние между электронами. При этом М. и. вида
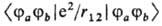
наз. кулоновскими. Они соответствуют классич. электростатич. взаимодействию двух зарядов, один из которых распределен в пространстве с плотностью rа(1) = j*a(1) × ja(1), а другой — с плотностью rb (2) = jb* (2) jb (2). Если переставить индексы а и b у функций, следующих за символом оператора e2/r12, получаются М. и. вида
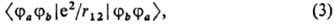
которые наз. о б м е н н ы м и. Появление обменных М. и. в выражениях для энергии и для др. свойств многоэлектронных мол. систем связано с принципом Паули и не имеет аналогии в классич. теории (см. обменное взаимодействие).
М. и. различают также по локализации орбиталей jа, jb,... Если эти орбитали локализованы у одного из атомных ядер молекулы (или в области между ядрами), т. е. если они относятся к одному центру (ядру или к.-л. точке в пространстве между ядрами), то М. и. наз. одноцентровыми; если ja относится к центру А, а jb — к центру В, говорят о д в у х ц е н т р о в ы х М. и., и т. д. При этом в число центров включаются и те, от переменных которых зависят также операторы А(1)или В(1,2); так, если A(1)-упомянутый выше оператор потенциальной энергии взаимод. электрона 1 с ядром С, то это ядро также считается центром для М. и.
Некоторые М. и. с одинаковыми названиями имеют разл. смысл в разных квантовохимических методах. Так, в методе Хюкке-ля резонансными М. и. наз. ненулевые недиагональные матричные элементы эффективного одноэлектронного гамильтониана (см. молекулярных орбиталей методы), а в полуэмпирических методах типа методов полного пренебрежения дифференц. перекрыванием резонансные М. и. — лишь такие слагаемые недиагональных матричных элементов фо-киана, которые при конкретных расчетах заменяются на те или иные комбинации эмпирич. параметров. В валентных связей методе обменными М. и. наз. матричные элементы 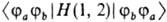 двухэлектронного гамильтониана H(1, 2) в базисе атомных орбиталей, что отличается от выражения (3) для обменных М. и. в методах мол. орбиталей.
двухэлектронного гамильтониана H(1, 2) в базисе атомных орбиталей, что отличается от выражения (3) для обменных М. и. в методах мол. орбиталей.
Расчет М. и. всегда представлял собой одну из важнейших вычислит. проблем квантовой химии, которая стала особенно острой в связи с развитием и широким применением неэмпирических методов. Для упрощения вычислений проводят поиск оптимальных базисных функций, которые позволяют получать наиб. простые формулы для расчета М. и. В частности, для многоатомных молекул оптимальными базисными функциями оказались орбитали гауссова типа (см. орбиталь). Еще более трудная проблема — рост числа М. и. с увеличением количества базисных орбиталей: если число последних — М, то число М. и. превышает М4/8. При М 102 приходится рассчитывать 107–108 М. и. Поскольку обычно мол. системы рассматривают в адиабатическом приближении, требующем вычислений в отдельности для каждой фиксированной геом. конфигурации ядер, а число таких конфигураций для многоатомных молекул достаточно велико даже при описании локальных участков поверхности потенциальной энергии, то становится ясным, какие трудности связаны с расчетами М. и. или пересчетом на каждом шаге итераций. Именно из-за этих трудностей активно разрабатывают полуэмпирич. методы, основанные, напр., на полном или частичном пренебрежении дифференц. перекрыванием. В подобных методах число М. и. увеличивается с ростом числа М базисных функций не быстрее, чем М2. В полуэмпирич. методах используют модельные представления, согласно которым отдельные М. и: либо некоторые их комбинации рассматривают как параметры, имеющие определенный физ. смысл. Подобный подход позволяет наглядно интерпретировать расчетные результаты и сопоставлять их для разных мол. систем.
102 приходится рассчитывать 107–108 М. и. Поскольку обычно мол. системы рассматривают в адиабатическом приближении, требующем вычислений в отдельности для каждой фиксированной геом. конфигурации ядер, а число таких конфигураций для многоатомных молекул достаточно велико даже при описании локальных участков поверхности потенциальной энергии, то становится ясным, какие трудности связаны с расчетами М. и. или пересчетом на каждом шаге итераций. Именно из-за этих трудностей активно разрабатывают полуэмпирич. методы, основанные, напр., на полном или частичном пренебрежении дифференц. перекрыванием. В подобных методах число М. и. увеличивается с ростом числа М базисных функций не быстрее, чем М2. В полуэмпирич. методах используют модельные представления, согласно которым отдельные М. и: либо некоторые их комбинации рассматривают как параметры, имеющие определенный физ. смысл. Подобный подход позволяет наглядно интерпретировать расчетные результаты и сопоставлять их для разных мол. систем.
Лит. см. при ст. квантовая химия.
Н. Ф. Степанов
