мицеллообразование
МИЦЕЛЛООБРАЗОВАНИЕ
самопроизвольная ассоциация молекул ПАВ в растворе. В результате в системе ПАВ-растворитель возникают м и ц е л л ы-ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы. В т. наз. прямых мицеллах ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу. Число молекул ПАВ, образующих мицеллу, наз. числом агрегации; по аналогии с мол. массой мицеллы характеризуются и т. наз. мицелляр-ной массой. Обычно числа агрегации составляют 50–100, мицеллярные массы равны 103–105. Образующиеся при М. мицеллы полидисперсные и характеризуются распределением по размерам (или числам агрегации).
М. характерно для разл. видов ПАВ-ионогенных (анион- и катионактивных), амфолитных и неионогенных и обладает рядом общих закономерностей, однако оно связано и с особенностями строения молекул ПАВ (размер неполярного радикала, природа полярной группы), так что правильнее говорить о М. данного класса ПАВ.
М. происходит в определенном для каждого ПАВ интервале температур, важнейшими характеристиками которого являются точка Крафта и точка помутнения. Точка Крафта-ниж. температурный предел М. ионогенных ПАВ, обычно она равна 283–293 К; при температурах ниже точки Крафта растворимость ПАВ недостаточна для образования мицелл. Точка помутнения-верх. температурный предел М. неионогенных ПАВ, обычные ее значения 323–333 К; при более высоких температурах система ПАВ-растворитель теряет устойчивость и расслаивается на две макрофазы (см. коацервация). Мицеллы ионогенных ПАВ при высоких температурах (388–503 К) распадаются на более мелкие ассоциаты-димеры и три-меры (т. наз. демицеллизация).
Критическая концентрация мицеллообразования (ККМ)~ концентрация ПАВ в растворе, при которой в системе образуются в заметных количествах устойчивые мицеллы. При низких концентрациях ПАВ (10−4–10−2 М) образуются истинные растворы, причем ионогенныe ПАВ ведут себя как сильные электролиты. При достижении ККМ мицеллы находятся в термодина-мич. равновесии с неассоциир. молекулами ПАВ; при разбавлении раствора мицеллы распадаются, а при увеличении концентрации вновь возникают. Выше ККМ весь избыток ПАВ находится в виде мицелл. При очень большом содержании ПАВ в системе образуются жидкие кристаллы или гели.
Существование ККМ выяснилось при анализе диаграмм состав-свойство (рис. 1). При ККМ наблюдается резкое отклонение свойств раствора ПАВ от идеальности со скачкообразным изменением свойств. На кривых зависимости некоторого свойства q от состава (концентрации ПАВ) в точке, соответствующей ККМ, наблюдаются перегибы, экстремумы, изломы и др. особенности. Математически ККМ-это точка на кривой состав-свойство, в которой производная (д2q/дc2)T или д2q/д(ln с)2 = 0. На практике имеется некоторая узкая область плавного, хотя и быстрого изменения рассматриваемого свойства. Значения ККМ для данной системы ПАВ-растворитель могут различаться при определении их тем или иным эксперим. методом или при использовании того или иного способа мат. обработки опытных данных.
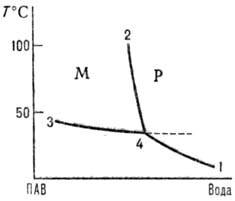
Рис. 1. Фазовая диаграмма системы лаурат калия-вода в области разбавленных растворов. Р-область истинной растворимости: М-область мицеллообразования. 1 — кривая истинной растворимости ПАВ; 2 — кривая мицеллообразования; 3 кривая перехода мицеллярной системы в гель или жидкокристаллич. фазу; 4 — точка Крафта.
Все эксперим. методы определения ККМ (их известно более 70) разделяют на две группы. К одной группе относят методы, не требующие введения в систему ПАВ-растворитель дополнит. компонентов. Это — построение изотерм поверхностного натяжения s(с) или s(lg с); измерение уд. электрич. проводимости (электрич. сопротивления) раствора ПАВ или эквивалентной электропроводности электролита l =f(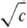 ); измерение частотной зависимости электропроводности электролита в переменном поле (эффект Вина); изучение оптич. свойств-показателя преломления раствора, светорассеяния в видимой области спектра; дифракц. методы, основанные на рассеянии рентгеновского излучения или нейтронов (особенно малоугловые измерения); изучение спектров поглощения и спектров ЯМР. Возможно определение ККМ кало-риметрич. методами-по уд. теплоте разбавления, а также по изменению температуры замерзания раствора или понижению давления пара. Наиб. четко ККМ определяется при построении зависимости растворимости ПАВ от величины 1/Т (обратной температуры). Существует целый ряд методов, основанных на процессах переноса: измерениях коэф. диффузии или вязкости, изучении электрофоретич. подвижности, ультрафильтрации и коэф. седиментации. Просты и надежны методы потен-циометрич. титрования и поглощения ультразвука.
); измерение частотной зависимости электропроводности электролита в переменном поле (эффект Вина); изучение оптич. свойств-показателя преломления раствора, светорассеяния в видимой области спектра; дифракц. методы, основанные на рассеянии рентгеновского излучения или нейтронов (особенно малоугловые измерения); изучение спектров поглощения и спектров ЯМР. Возможно определение ККМ кало-риметрич. методами-по уд. теплоте разбавления, а также по изменению температуры замерзания раствора или понижению давления пара. Наиб. четко ККМ определяется при построении зависимости растворимости ПАВ от величины 1/Т (обратной температуры). Существует целый ряд методов, основанных на процессах переноса: измерениях коэф. диффузии или вязкости, изучении электрофоретич. подвижности, ультрафильтрации и коэф. седиментации. Просты и надежны методы потен-циометрич. титрования и поглощения ультразвука.
Вторая группа методов измерения ККМ основана на добавлении в растворы дополнит. компонентов и их солюбили-зации (коллоидном растворении) в мицеллах ПАВ, которую можно регистрировать с использованием спектральных методов, флуоресценции, ЭПР и др.
Теория М. Согласно т. наз. псевдофазной модели, М. рассматривается как процесс, аналогичный фазовому переходу, при котором происходит резкий переход от молекуляр-но-дисперсного состояния ПАВ в растворителе к ассоциированному в мицеллы ПАВ при ККМ. Мицеллы рассматриваются как предельная высокодисперсная фаза ("псевдофаза"), а ККМ-как такая концентрация, при которой хим. потенциал ПАВ в растворе становится равным хим. потенциалу этого вещества, ассоциированного в мицеллы. Концентрация неассоциир. молекул ПАВ, соответствующая истинному раствору, остается постоянной и равной ККМ при любом количестве ПАВ в растворе. Эта модель удобна для описания ряда макроскопич. свойств растворов ПАВ и их зависимостей от концентрации, однако она не позволяет определять размер и форму мицелл.
В т. наз. квазихим. модели М. рассматривается как обратимая химическая реакция типа:
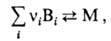
где Вi-молекула ПАВ i-го сорта, vi-число агрегации, М-мицелла. К данной реакции м. б. применен закон действующих масс, тогда число агрегации можно сопоставлять с константой равновесия процесса мицеллярной агрегации в системе. Модель объясняет резкость перехода для систем с большими числами агрегации и дает практически такую же зависимость от концентрации ПАВ числа мицелл и неассоциир. молекул в системе, как и псевдофазная модель. Т. наз. полиравновесная модель М. является развитием квазихим. модели, но М. представляется как последоват. ассоциация "мономеров". Модель объясняет распределение мицелл по размерам. Она обосновывает понятие ККМ как величины, обратной макс. константе ассоциации (равновесия), которая наблюдается при некотором критич. числе агрегации.
Установлена корреляция между поверхностной (межфазной) активностью ПАВ, его способностью снижать поверхностное и межфазное натяжение (на границе раствора с воздухом или др. жидкостью) и ККМ. Чем больше поверхностная активность ПАВ, тем большая склонность к М. характерна для этого ПАВ и тем ниже ККМ. Согласно этим данным, ККМ-это концентрация, при которой термодинамич. активность неассоциир. молекул ПАВ, его поверхностная активность на разл. субстратах достигает предельного значения (в отличие от молекул ПАВ мицеллы поверхностно неактивны). Из ряда эксперим. зависимостей состав-свойство возможно представление о ККМ как о предельной концентрации, характеризующей свойства мицелл при бесконечном разбавлении системы ПАВ-растворитель.
Строение и свойства мицелл ПАВ обусловлены межмолекулярными взаимодействиями между компонентами системы. В случае водных растворов ионогенных ПАВ устойчивость мицелл определяется равенством сил притяжения неполярных (углеводородных) частей молекул и отталкиванием полярных (ионогенных) групп. Силы притяжения углеводородных частей молекул ПАВ в воде можно отождествить с гидрофобными взаимодействиями, которые обусловливают кооперативность М.; отталкивание полярных групп приводит к ограничению роста мицелл. Могут быть и др. причины, приводящие к ограничению роста мицелл, такие, как геометрия молекул ПАВ, зависимость поверхностного натяжения на границе раздела мицелла-растворитель от радиуса мицеллы. В неводных полярных средах (этиленгликоль, глицерин и др.) при М. возникают лиофобные взаимод. между углеводородными частями молекул ПАВ, аналогичные гидрофобным.
Большинство эксперим. данных свидетельствует о том, что вблизи ККМ в водных растворах мицеллы представляют собой идеально сферич. частицы как в случае катион- и анионактивных, так и неионогенных ПАВ (рис. 2). Гидрофобные части дифильных молекул ПАВ образуют внутр. область (ядро) мицеллы, полярные концы молекул образуют поверхностный слой и всегда гидратированы, т. е. связаны с одной или неск. молекулами воды. Упорядоченность ядра мицеллы является промежуточной между жидким и кристаллич. состояниями непредельных углеводородов (алканов).
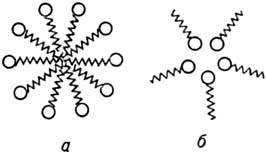
Рис. 2. Схематическое изображение ассоциатов ПАВ в воде: а — сферич. прямая мицелла; б — обращенная мицелла.
В сильно неполярных средах полярные группы дифильных молекул становятся лиофобными; в результате формируются мицеллы, в которых ядро образовано полярными группами (т. наз. обращенные мицеллы). Числа агрегации в обращенных мицеллах малы по сравнению с числами агрегации в мицеллах, образующихся в водных средах. Агрегация ПАВ в неводных средах резко изменяется в присутствии даже следов воды. В последние годы для прямых мицелл предложены новые сферич. модели, среди которых наиб. обоснованной представляется модель, полученная на основе изучения малоуглового рассеяния нейтронов мицеллярными растворами ПАВ. Согласно этой модели, часть мицеллярной поверхности занята метиленовыми и концевыми метильными группами, которые находятся в контакте с водой.
Кинетика М. изучена разл. методами, используемыми для быстрых процессов. Показано, что М. — кооперативный процесс, включающий быстрые ассоциативно-диссоциативные равновесия. Релаксац. спектры мицеллярных систем имеют характерные времена от секунды до 10−9 с. Времена релаксации 10−6–10−9 с связаны с процессом обмена типа неассоциир. молекула ПАВ — мицелла (быстрая релаксация), а времена релаксации от секунды до 10−3 с (медленная релаксация) связаны с изменением чисел агрегации мицелл. Одновременное определение времен быстрой и медленной релаксации позволяет независимым путем определять числа агрегации при М.
Поскольку высокая поверхностная активность ПАВ сопряжена с малой "истинной" (молекулярной) растворимостью, М. является исключительно важным для практики явлением, которое позволяет иметь в растворе "депо"-запас ПАВ, во много раз превосходящий мол. растворимость. М. обеспечивает такие важные технол. свойства мицеллярных систем, как солюби-лизация, моющее действие, образование микроэмульсий. Эти свойства позволяют ПАВ выполнять роль стабилизаторов разнообразных дисперсных систем.
Лит.: Мицеллообразовапие, солюбилизация и микроэмульсии, пер. с англ., М., 1980; Гормелли Дж., Геттинз У., Уин-Джонс Э., в кн.: Молекулярные взаимодействия, пер. с англ., М., 1984, с. 151–83.
Г. П. Ямпольская
Значения в других словарях
- мицеллообразование — орф. мицеллообразование, -я Орфографический словарь Лопатина
- МИЦЕЛЛООБРАЗОВАНИЕ — МИЦЕЛЛООБРАЗОВАНИЕ — самопроизвольная ассоциация молекул поверхностно?активных веществ (ПАВ) в растворе. В результате мицеллообразования возникают мицеллы, состоящие из десятков молекул с длинноцепочечными гидрофобными радикалами (см. Большой энциклопедический словарь
