манганаты
МАНГАНАТЫ
соли несуществующих в своб. состоянии кислот Mn. Содержат тетраэдрич. анионы MnO4−, MnO42− или MnO43−. Манганаты (VII) (перманганаты) — соли марганцовой кислоты НMnO4; известны для щелочных и щел.-зем. металлов, аммония, Ag и Al. Фиолетово-черные кристаллы (см. табл.). Раств. в воде. Для перманганатов Li, Na и Ca известны кристаллогидраты. Твердые M.(VII) термически неустойчивы, медленно разлагаются с выделением O2 уже при комнатной температуре, скорость разложения возрастает в присутствии воды и при нагревании. В присут. восстановителей могут разлагаться со взрывом. М.(VII) — очень сильные окислители. В щелочной среде MnO4− восстанавливается до MnO42−, в нейтральной — до MnO2, в кислой — до Mn(II). M.(VII) используют в аналит. химии для определения металлов, оксалатов, иодидов, бромидов и др. соед. (см. перманганатометрия).
СВОЙСТВА НЕКОТОРЫХ МАНГАНАТОВ
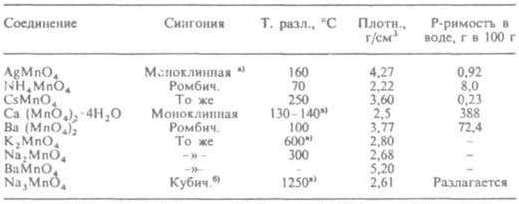
а) a = 0,567 нм, b = 0,827 нм, c = 0,713 нм, β = 92,6°. б) a = 0,7595 нм. в) Т. пл.
Марганцовая кислота HMnO4 образуется при действии на перманганаты конц. H2SO4 и существует только в подкисленных водных растворах; разлагается до Mn2O7 и H2O; сильный окислитель. Манганаты (VI) (манганаты) — соли марганцоватой кислоты H2MnO4; известны только для щелочных металлов и Ва. Зеленые кристаллы. При нагр. разлагаются до M.(V), MnO2 и O2. Окислители; восстанавливаются до Mn(IV) в нейтральной среде и до Mn(II) — в кислой. Сильные окислители (напр., Cl2) окисляют M.(VI) до M.(VII). В нейтральном и кислом растворе возможно диспропорционирование M.(VI) до M.(VII) и M.(IV). При действии кислот на M.(VI) образуется H2MnO4, которая быстро разлагается на MnO2 и НMnO4. M.(VI) легко образуют двойные соли с сульфатами и хроматами металлов. M.(VI) получают в промышленности анодным окислением Mn в расплаве щелочи или MnO2, в лаборатории м. б. получены термич. разложением M.(VII) при контролируемых условиях. Манганаты (V) (гипоманганаты) — соли марганцоватистой кислоты H3MnO4; известны только для Li, Na, К и Ва. Зеленые кристаллы. В водном растворе быстро происходят диспропорционирование M.(V) до M.(VI) и MnO2 и реакция с перманганатами MnO43− + MnO4− : 2MnO42−. Получают M.(V) пропусканием O2 через расплав смеси MnO2 с NaOH (атомное отношение Na → Mn = 3 : 1) при 800 °C либо восстановлением растворов M.(VII) сульфитом Na. Соед. типа CaMnO3, Mg6MnO8 и др. представляют собой не соли, а двойные оксиды; в воде не растворяются. Наиб. важное практич. значение имеет калия перманганаты K2MnO4 — промежут. продукт в пром. схемах получения KMnO4 из MnO2; ВаMnO4 (касселева, или марганцовая, зелень) — зеленый пигмент, обычно используемый для фресковой живописи; Ва3(MnO4)2 — голубой пигмент для пластмасс, художеств. красок и эмалей; Ca3(MnO4)2.5H2O применяют для стерилизации питьевой воды. M.(V) входят в состав малярной краски — марганцевой синей.
П. М. Чукуров
Значения в других словарях
- Манганаты — Соли марганцовистой кислоты (См. Марганцовистая кислота) H2MnO4. Большая советская энциклопедия
- МАНГАНАТЫ — МАНГАНАТЫ — соли марганцовой кислоты HMnO4 — перманганаты, фиолетово-черные кристаллы, а также марганцоватой H2MnO4 и марганцоватистой H3MnO4 к-т — зеленые кристаллы. Растворяются в воде. Окислители. См. также Калия перманганат. Большой энциклопедический словарь
