катионная полимеризация
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ
ионная полимеризация, в которой растущий конец полимерной цепи несет положит, заряд. К этой полимеризации способны: олефины, ароматич. соединения с ненасыщ. боковой цепью, алифатич. альдегиды и тиоальдегиды, виниловые эфиры и тиоэфиры, кетены, нитрилы, диазоалканы, цианамиды, изоцианаты, напряженные циклоалканы (напр., циклопропан), гетероциклич. простые и сложные эфиры, ацетали, амиды, амины, сульфиды, дисульфиды, силоксаны, иминоэфиры. В К. п. наиб. активны мономеры, имеющие в α-положении к двойной связи электронодонорные заместители (напр., изобутилен, α-метилстирол, винилалкиловые эфиры, изопрен). Реакц. способность гетероциклич. соед. определяется природой гетероатома и размером цикла. Введение заместителя в цикл существенно влияет на его активность. К. п. протекает под действием: 1) протонных кислот — HClO4, H3PO4, H2SO4, CF3COOH и др.; 2) апротонных кислот (кислоты Льюиса) — BF3, SbCl5, SnCl4, AlCl3, TiCl4, ZnCl2 и др.; 3) галогенов и межгалогенных соед. — I2, IC1, IBr; 4) карбениевых солей — Pb3С+А−, C7H+7А− (здесь и ниже А−=SbCl−, PF−6 и др.); 5) алкоксикарбениевых солей — ROCH+2A−(R=CH3, C2H5 и др.); 6) оксониевых солей — R3O+А−; 7) алкилпроизводных металлов — ZnR2, A1R3; 8) излучений высокой энергии. Считают, что для инициирования К. п. ненасыщ. углеводородов апротонными кислотами и металлалкилами необходимо присутствие соинициатора (протонодонорной добавки), напр. H2O или HHal. В большинстве случаев макс. скорости полимеризации соответствует определенное соотношение количеств инициатора и соинициатора. К. п. — цепной процесс, в общем случае включающий три стадии: 1) инициирование — образование активных центров, несущих положит, заряд; 2) рост цепи — присоединение мономера (М) к активному центру; 3) ограничение роста цепи-обрыв и передача цепи. Образование активных центров-во мн. случаях сложный процесс, нередко включающий более одного элементарного акта. В стадии, предшествующей инициированию, из компонентов инициирующей системы (инициатор, соинициатор, мономер — если он выполняет функцию соинициатора) образуются первичные активные частицы. Известны след, их типы: катионы К+ (А−), цвиттер-ионы К+—А−, ион-радикалы К∙+, координац. комплексы неионного характера. Наиб. часто инициирование К. п. осуществляется катионами:
К+ А−)+М:КМ+(А−)
Частицы КМ+(А−) и образующиеся при росте цепи К~М+(А−) — активные центры полимеризации [упрощенно их можно обозначить как М+ (А−)]. При К. п. ненасыщенных соед. — это карбениевые ионы, при К. п. гетероциклич. соед. — как правило, ониевые (оксониевые, аммониевые, сульфониевые и т. п.). Акт роста цепи при К. п. ненасыщенных соед. происходит по типу присоединения, в случае гетероциклич. соед. — по типу замещения. Например:
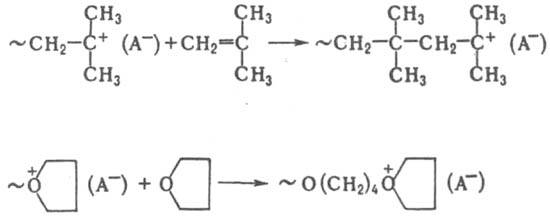
В общем виде для активного центра К. п. можно представить ряд состояний от ковалентного (I) до своб. ионов (IV); промежут. состояния — контактная ионная пара (II) и сольватно разделенная ионная пара (III):
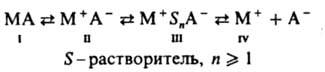
В условиях, способствующих более сильным ионным взаимод., активные центры могут существовать в виде более сложных ионных ассоциатов — ионных тройников типа (М+А−М+) или (А−М+А−), квадруполей и т. п. Та или иная форма активных центров превалирует в равновесии в зависимости от полярности среды, сольватирующей способности растворителя и мономера, природы противоиона, температуры и концентрации реагентов. Известны системы (напр., ТГФ, полимеризующийся под действием CF3SO3F), в которых при изменении полярности среды реализуются предельные случаи равновесия. В среде CCl4 активные центры более чем на 95% имеют ковалентную форму, в CH3NO2 — ионную. Все активные центры могут участвовать в росте цепи, проявляя разл. активность. Так, скорость роста на активных центрах ковалентной структуры на неск. порядков ниже скорости роста на ионных активных центрах. Во мн. случаях степень участия каждой из форм активных центров в росте цепи оценить не представляется возможным. По этой причине в эксперим. исследованиях обычно ограничиваются определением т. наз. эффективной константы скорости роста полимерной цепи (kэффр), представляющей собой сумму произведений доли каждой из форм на соответствующее значение kp. Рост цепи при полимеризации некоторых разветвленных олефинов (напр., 3-метил-1-бутена) может осложняться изомеризацией растущего конца цепи. Мол. масса продуктов К. п. часто невысока, что обусловлено передачей и обрывом цепи при взаимодействии активного центра с противоионом, мономером, полимером, растворителем и примесями. Наиб. ощутимо ограничение роста цепи при К. п. олефинов из-за высокой активности карбениевых ионов. Ониевые ионы (активные центры К. п. гетероциклов) обладают большей стабильностью, некоторые циклич. простые и сложные эфиры (напр., ТГФ, гликолид), амины (напр., 1-метилазиридин, конидин), иминоэфиры (2-метил-2-оксазолин) при определенных условиях полимеризуются на ониевых активных центрах без заметной передачи и обрыва цепи, т. е. образуют живущие полимеры. В тех случаях, когда обрыв цепи не играет существ, роли, а инициирование протекает быстро, для описания равновесного процесса используют простую кинетич. зависимость:
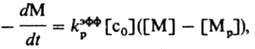
где [с0] — начальная концентрация инициатора, [М] и [Mp] — начальная и равновесная концентрации мономера соответственно. В др. случаях кинетич. зависимости имеют более сложный характер, существенно зависящий от способа инициирования и обрыва цепи в каждой конкретной системе. К. п. используют для многотоннажного производства технически важных полимеров и олигомеров изобутилена, бутилкаучука, статистич. сополимера триоксана и этиленоксида, поливинилизобутилового эфира. Основы научного фундамента К. п. заложены в 30-е гг. 20 в. (Ф. Уитмор, Х.Л. Меервейн, P.M. Томас). Кон. 50-х гг. можно считать периодом становления как теории, так и технологии катионных процессов.
Лит.: Кеннеди Дж., Катионная полимеризация олефинов, пер. с англ., М., 1978; Encyclopedia of polymer science and technology, SuppL, v. 2, N. Y., 1977, p. 161 97; Penczek S., Kubisa P., Matyjaszewsky К„ в кн.. Advances in polymer science, v. 37, В., 1980. 1 144.
З. Н. Нысенко
