индий
ИНДИЙ [назван по синей (цвета индиго) линии спектра; лат. Indium] In
хим. элемент III гр. периодической системы; ат. н. 49, ат. м. 114,82. Прир. И. состоит из двух изотопов 115In (95,7%) и 113In (4,3%). Первый слабо радиоактивен (β-излучатель, T1/25∙1014 лет). Конфигурация внеш. электронной оболочки 5s25p1; степень окисления +3, редко +1; энергия ионизации In0 : In1+ : In2+ : In3+ соотв. равна 5,786390, 18,8700 и 28,03 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,166 нм, ионные радиусы (в скобках указано координац. число) для In3+ 0,076 нм (4), 0,094 нм (6), 0,106 нм (8). И. относится к рассеянным элементам. Содержание его в земной коре 10−5 % по массе, в воде морей и океанов менее 0,02 мг/л. Известно 5 минералов — самородный И., индит FeIn2S4, рокезит CuInS2, джалиндит In(OH)3, сакуранит (Cu, Zn,Fe)3(In,Sn)S4. И. является спутником Zn, Sn, Pb, в меньшей мере — Cu и Fe. Присутствует в сфалеритах, касситеритах, галенитах, халькопиритах (10−4—10−2%), пиритах и пирротинах (до 10−3 %). Наиб. содержание И. — в высокотемпературных гидротермальных месторождениях касситеритсульфидного и олово-сульфосольного типов. Извлекается И. из руд свинцово-цинковых, медно-колчеданных и колчеданно-полиметаллич. месторождений. Мировые ресурсы ок. 3100 т, в т. ч. промышленные 1550 т.
Свойства. И. — серебристо-белый металл; кристаллич. решетка тетрагональная, а = 0,32512 нм, с = 0,49467 нм, z = 2, пространственная группа I4/ттт. Т. пл. 156,78 °C, т. кип. 2024 °C; плотн: 7,31, жидкого И. 7,03 г/см3 (160 °C); C0p 26,7 Дж/(моль∙К); ΔH0пл 3,26 кДж/моль, ΔH0исп 237,4 кДж/моль; S0298 57,86 Дж/(моль∙К); уравнение температурной зависимости давления пара: lgp(в гПа) = 9,454 — 12593Т−1 — 0,1901gT + 1,320∙10−3T (82 — 430 К), lgp(в гПа) = 9,076 — 12216T−1 + 0,2161gT(430 −2285 К); температурный коэф. линейного и объемного расширения соотв. 30,0∙10−6K−1 (293–333 К) и 101∙10−6 К−1 (298–323 К); теплопроводность 87,0 Вт/(м∙К) при 273 К; температура перехода в сверхпроводящее состояние 3,405 К; ρ ~ 10−7 Ом∙м, температурный коэф. ρ 4,9∙10−3 К−1 (273–373 К); диамагнитен, магн. восприимчивость — 0,56∙10−9. Очень мягок и пластичен; твердость по Моосу ~ 1, по Бринеллю 8,8–10,0 МПа; модуль упругости 11 ГПа; σраст 2,9–3,9 МПа. Стандартный электродный потенциал для In0/In3+ —0,34 В. И. устойчив на воздухе, но выше ~ 800 °C горит фиолетово-синим пламенем с образованием In2O3 (см. индия оксиды). В воде в присутствии воздуха постепенно корродирует. Медленно реагирует с минеральными кислотами (легче всего с HNO3) и орг. кислотами. Взаимод. с Cl2 и Br2, при нагр. с I2, при сплавлении с халькогенами. Не взаимод. с N2, H2, NH3, В, С. Важнейшим соед. И. посвящены отдельные статьи (см. индия антимонид, индия арсенид, индия фосфид). Ниже приводятся сведения о других соединениях И. Сульфат In2(SO4)3 светло-серые кристаллы с моноклинной решеткой; плотн. 3,44 г/см3, выше 600 °C разлагается до In2O3; гигроскопичен; раств. в воде (54% по массе при 20 °C), в водных растворах гидролизован; из растворов кристаллизуется при комнатной температуре в виде пента- и декагидратов, которые обезвоживаются при ~ 200 °C. При действии этанола, растворов щелочи или NH3 (pH 2–3) на водные растворы сульфата И. выпадает осадок гидроксисульфата In(OH)SO4.2H2O. В присут. избытка сульфат-иона образуются комплексные ионы [In(SO4)2] и [In(SO4)3]3 , соответствующие им гидросульфаты кристаллизуются из растворов, содержащих H2SO4. Нитрат In(NO3)3.4,5H2O — расплывающиеся на воздухе кристаллы; т. пл. 74 °C; при 100–160 °C разлагается до оксинитрата InONO3, при 230–250 °C — до In2O3; хорошо раств. в воде и этаноле. Получают взаимод. металла с HNO3. Используют для получения In2O3 и др. соединений И. Ортофосфат InPO4 — кристаллы с ромбич. решеткой; т. пл. 1600 °C; выше 1800 °C разлагается; плотн. 3,91 г/см3; не раств. в воде; разлагается растворами щелочей и конц. минеральными кислотами. Получают в виде дигидрата (который обезвоживается выше 300 °C) при действии H3PO4 на растворы солей И. Используют как добавку к шихте при производстве спец. стекол и к зубным цементам. Свойства важнейших галогенидов И. приведены в табл. 1.
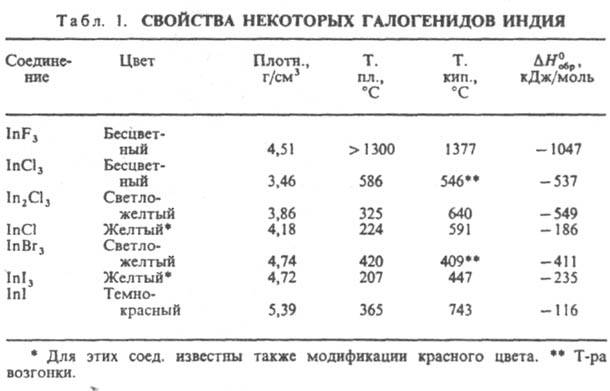
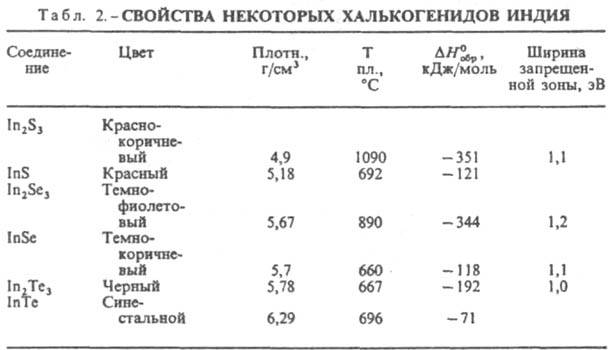
Безводный трифторид InF3 не раств. в воде; получают его фторированием И., тригидрат InF3.3H2O — взаимод. оксида или гидроксида И. с фтористоводородной кислотой. Тригидрат при нагр. разлагается с образованием оксифторида InOF; раств. в воде (5,8% по массе при 25 °C); разлагается при действии минеральных кислот и щелочей. Безводный трихлорид InCl3 очень гигроскопичен, расплывается на воздухе; раств. в воде (63% по массе при 20 °C), этаноле, диэтиловом эфире, ацетоне; получают хлорированием металла при незначит. нагревании. Кристаллизуется из водных растворов в виде тетрагидрата InCl3.4H2O с т. пл. 56 °C; при более высоких температурах разлагается с образованием нерастворимого в воде оксихлорида InOCl. При сплавлении безводного InCl3 с металлич. И. можно получить монохлорид, а также ряд промежут. хлоридов — In3Cl4, In2Cl3 и др. Они представляют собой комплексные соед., напр., сесквихлорид In2Cl3 имеет строение In3I [InIII Cl6]. Все они гигроскопичны, при действии воды диспропорционируют на металлич. И. и InCl3. Хлориды И. — промежут. продукты при получении И. высокой чистоты. Трибромид и трииодид И. по свойствам напоминают InCl3, но менее реакционноспособны (особенно InI3). InBr3 получают действием паров Br2 на нагретый металл, InI3 -сплавлением элементов. Используют их для синтеза соед. И. с полупроводниковыми свойствами. InI3 и InI — компоненты наполнителя металлогалогенных ламп. В отличие от InCl и InBr моноиодид И. негигроскопичен и при комнатной температуре почти не взаимод. с водой. Растворимость InI в воде 4,7∙10−4 моль/л. Его можно осаждать из водных растворов, напр., при анодном растворении И. Свойства важнейших халькогенидов И. приведены в табл. 2. Для И. характерно образование халькогенидов типов In2X, InX, In2X3, а также промежут. соед. между InX и In2Х3 и веществ с большим содержанием халькогена. Соед. In2Х метастабильны, плавятся инконгруэнтно, обладают большой летучестью; InX и In2Х3 плавятся конгруэнтно. Халькогениды InS и InSe имеют слоистую структуру типа GaS со связью металл-металл. Для InTe характерна резкая анизотропия свойств: вдоль оси кристалла он имеет металлич. проводимость, в перпендикулярном направлении — полупроводниковую. Халькогениды И. не раств. в воде, реагируют с конц. кислотами и растворами щелочей. Обладают полупроводниковыми свойствами. Получают халькогениды сплавлением соответствующих элементов. Соед. InX и In2Х3, как и некоторые сложные халькогениды, напр. CuInSe2, — перспективные полупроводниковые материалы. Соед. И. с элементами V гр. (InAs, InSb, InP) — полупроводниковые материалы.
Получение. Сырье для получения И. — отходы и промежут. продукты свинцово-цинкового и оловянного производств. И. выщелачивают из них серной кислотой. Для отделения И. от сопутствующих металлов и концентрирования растворов используют экстракцию, напр., раствором ди-2-этилгексилфосфорной кислоты в керосине, или ионный обмен, напр., на фосфорнокислых катионитах.
Выделяют И. из растворов электролизом либо цементацией на металлич. Al (т. е. вытеснением И. из раствора по реакции: In3+ + Al0 ⇄ In0 + Al3+) с послед. переплавкой под слоем щелочи. Для очистки И. используют чаще всего электролитич. рафинирование, вакуумную обработку для удаления летучих примесей, зонную плавку или вытягивание кристаллов из расплава. Предложен также ряд методов очистки И. с промежут. образованием его соед., в частности хлоридов.
Определение. Качественно И. может быть обнаружен по сине-фиолетовому окрашиванию пламени или спектральным методом. Предложен ряд реакции с CsCl, фторидом, тиоцианатом, оксалатом аммония, акридином, 8-гидроксихинолином и др., а также ряд цветных реакций с ализарином, морином, алюминоном и др. реагентами. Эти хим. реакции малоспецифичны и требуют предварит. отделения И. от большинства др. элементов. Для количеств. определения И. применяют комплексонометрию, а также амперометрич. титрование с K4[Fe(CN)6]. Гравиметрич. методом И. определяют в виде In2O3, In2S3, 8-гидроксихинолината. Для определения малых количеств И. используют радиоактивац., спектральный, полярографич. методы. Предварительно производится концентрирование И. методами экстракции, электролиза или соосаждения.
Применение. И. легирующая добавка к полупроводниковым Ge и Si; герметизирующий материал в вакуумных приборах и космич. аппаратах; материал для соединения пьезоэлектрич. кристаллов. Его используют также для нанесения покрытий на поверхность подшипников, зеркал и рефлекторов, как компонент легкоплавких сплавов, применяемых в качестве припоев, в термоограничителях, предохранителях, сигнальных устройствах, в радиац. контурах ядерных реакторов. Мировое произв-во И. (без СССР) ок. 60 т/год (1984). Осн. производители — Япония, Канада, США, Бельгия, Перу. И. токсичен; ПДК 0,1 мг/м3 (в США). Пыль И. и его соед. может вызвать воспалит. и склеротич. поражения легких, вредно действует на печень и селезенку. Растворимые соед. И. раздражают кожу, глаза, слизистые оболочки. По некоторым данным, И. малотоксичен при введении в желудок и внутривенно. И. открыт Ф Рейхом и И. Рихтером в 1863.
Лит.: Федоров П. И., Мохосоев М. В., Алексеев Ф. П., Химия галлия, индия и таллия, Новосиб., 1977; Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1, М., 1976, с. 281–325; Шека З. А., Шека И. А., Галогениды индия и их координационные соединения, К., 1981; Смирнов В. А., Дмитриев B. C., Редькин А. Н., Химия одновалентного индия, М., 1986; Яценко С .П., Индий: свойства и применение, М., 1987.
П. И. Федоров
Значения в других словарях
- индий — -я, м. Химический элемент, редкий мягкий металл серебристо-белого цвета. [лат. Indium] Малый академический словарь
- индий — И́нд/ий/. Морфемно-орфографический словарь
- Индий — (лат. Indium) In, химический элемент III группы периодической системы Менделеева; атомный номер 49, атомная масса 114,82; белый блестящий мягкий металл. Большая советская энциклопедия
- индий — орф. индий, -я Орфографический словарь Лопатина
- Индий — In (по синей, цвета индиго. линии спектра * a. indium; н. Indium; ф. indium; и. indio), — хим. элемент III группы периодич. системы Менделеева, ат. н. 49, ат. м. 114,82. Горная энциклопедия
- ИНДИЙ — ИНДИЙ (символ In), серебристо-белый металл III группы периодической таблицы. Побочный продукт, получаемый при очистке цинка. Благодаря ковкости и вязкости используется в некоторых сплавах с низкой температурой плавления, в полупроводниках... Научно-технический словарь
- индий — ИНДИЙ -я; м. [лат. Indium] Химический элемент (In), редкий мягкий металл серебристо-белого цвета (компонент легкоплавких сплавов и полупроводниковых материалов). ◁ Индиевый, -ая, -ое. И-ая руда. Толковый словарь Кузнецова
- индий — [лат. Indium] – редкий хим. элемент, символ In, порядковый номер 49, атомный вес 114,76; мягкий белый металл; плавится при температуре 155°, но не испаряется даже при температуре 1450° Большой словарь иностранных слов
- индий — индий м. Химический элемент, мягкий металл серебристо-белого цвета. Толковый словарь Ефремовой
- ИНДИЙ — ИНДИЙ (лат. Indium) — In, химический элемент III группы периодической системы, атомный номер 49, атомная масса 114,82. Серебристо-белый металл, легкоплавкий и очень мягкий; плотность 7,31 г/см3, tпл 156,78 °С. На воздухе устойчив. Большой энциклопедический словарь
- Индий — (хим.) — подобно галлию и некотор. друг. металлам, открыт (1863) с помощью спектрального анализа Рейхом и Рихтером во Фрейберге, при исследовании встречающейся там цинковой обманки. Энциклопедический словарь Брокгауза и Ефрона
