железа сульфаты
ЖЕЛЕЗА СУЛЬФАТЫ
Сульфат железа(II) FeSO4 — бесцв. очень гигроскопичные кристаллы (см. табл.); раств. в воде. Из водного раствора при температурах от −1,82 до 56,8 °C кристаллизуется гептагидрат, в интервале 56,8–64 °C — тетрагидрат, выше 64 °C — моногидрат. Гептагидрат FeSO4.7H2O (техн. назв. — железный купорос, в природе — минерал мелантерит) — голубовато-зеленые кристаллы; раств. в воде (14,91% по массе FeSO4 при −1,8 °C, 21,01% при 20 °C, 35,06% при 56,7 °C), метаноле, этаноле, глицерине; при нагр. на воздухе в результате дегидратации и окисления гептагидрата образуются FeSO4.H2O, FeSO4, Fe(OH)SO4, Fe2(SO4)3, Fe2O3 и SO3. Тетрагидрат FeSO4.4H2O — зеленые кристаллы, моногидрат FeSO4.H2O — бесцветные кристаллы. Водный раствор FeSO4 — восстановитель во мн. реакциях. FeSO4 образует аддукты с NO — (FeSO4)x.(NO)y, метанолом — FeSO4.1,5CH3OH, анилином — FeSO4.2C6H5NH2. Известны также комплексы с 2,2'-дипиридилом [Fe(C10H8N2)3]SO4, фенантролином [Fe(C12H8N2)3]SO4, аминами. Из раствора, содержащего сульфаты Fe(II) и NH4+ кристаллизуется двойной сульфат FeSO4.(NH4)2SO4.6H2O (соль Мора) — сине-зеленые кристаллы, устойчивые на воздухе. Безводный FeSO4 получают прокаливанием пирита FeS2, дегидратацией гептагидрата в вакууме или в среде H2, кристаллогидраты — из травильных растворов металлообрабатывающих заводов, а также из сбросных растворов титанового производства. FeSO4 — компонент электролита в гальванотехнике, консервант древесины, фунгицид; его используют также для получения пигментов, как реагент для обнаружения NO3−, MnO4−, Ce4+, антианемич. средство, восстановитель. Сульфат железа (III) Fe2(SO4)3 — светло-желтые очень гигроскопичные кристаллы; раств. в воде, ацетоне, не раств. в этаноле. Из водного раствора кристаллизуется в виде кристаллогидратов Fe2(SO4)3.nH2O, где n = 12, 10, 9, 7, 6, 3. Нонагидрат Fe2(SO4)3.9H2O — желтые кристаллы; в природе — минерал кокимбит; раств. в воде (440 г в 100 г воды при 20 °C), этаноле, гидразине, не раств. в ацетоне.
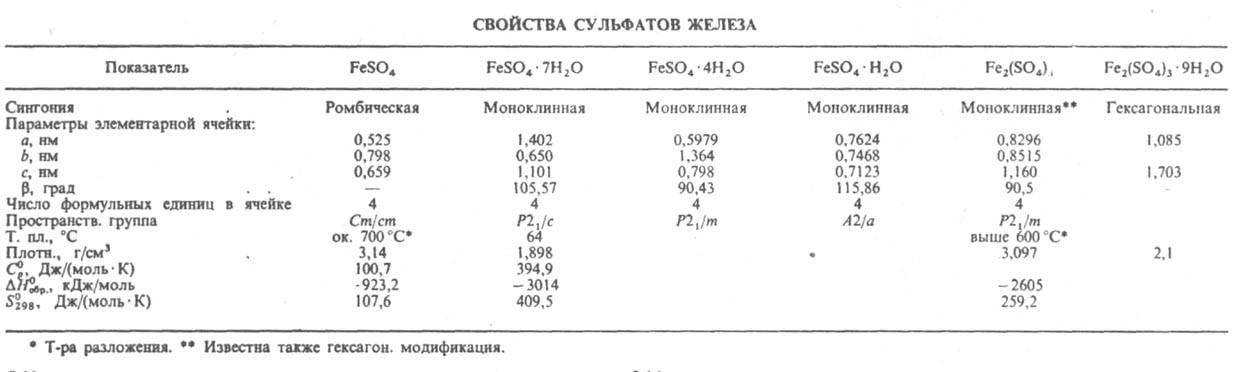
В водных растворах сильно гидролизован. Fe2(SO4)3 образует с NH3 аммиакат Fe2(SO4)3.12NH3, с сульфатами щелочных металлов и аммония — квасцы M1Fe(SO4)2.12H2O, а также комплексные сульфаты состава М1[Fe(SO4)3].3H2O. При нагр. нонагидрат превращ. при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3. Сульфат Fe(III) получают прокаливанием FeS2 с NaCl на воздухе, раствор Fe2(SO4)3 — взаимод. Fe2O3 с 75–80%-ной H2SO4. Применяют Fe2(SO4)3 для декапирования нержавеющих аустенитных сталей, сплавов Cu с Al, как компонент электролита в гальванотехнике, раствора в гидрометаллургии Cu, для получения квасцов, пигмента Fe2O3, как коагулянт при очистке воды, протраву при крашении.
Лит.: Рипан Р., Четяну И., Неорганическая химия, т. 2, М., 1972, с. 511, 526; Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974, с. 694–707.
В. П. Данилов
Значения в других словарях
- Железа сульфаты — Сернокислые соли 2- и 3-валентного железа, FeSO4 и Fe2(SO4)3. Сульфат 2-валентного железа выделяется при температурах от 1,82 °С до 56,8 °С из водных растворов в виде светло-зелёных кристаллов FeSO4 x 7H2О, называется в технике железным купоросом. Большая советская энциклопедия
- ЖЕЛЕЗА СУЛЬФАТЫ — ЖЕЛЕЗА СУЛЬФАТЫ: FeSO4 и Fe2(SO4)3. Образуют кристаллогидраты. FeSO4·7H2O (железный купорос) применяют в производстве чернил, для окраски шерсти в черный цвет, консервации древесины, как фунгицид. Большой энциклопедический словарь
