дипольный момент
ДИПОЛЬНЫЙ МОМЕНТ электрический
векторная величина, характеризующая асимметрию распределения положит. и отрицат. зарядов в электрически нейтральной системе. Два одинаковых по величине заряда +q и —q образуют электрич. диполь с Д. м. m = q l, где l — расстояние между зарядами. Для системы из n зарядов qi радиусы-векторы которых ri, 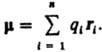 В молекулах и мол. системах центры положит. зарядов qА совпадают с положениями атомных ядер (радиусы-векторы rA), а электронное распределение описывается плотностью вероятности ρ(r). В этом случае Д. м.
В молекулах и мол. системах центры положит. зарядов qА совпадают с положениями атомных ядер (радиусы-векторы rA), а электронное распределение описывается плотностью вероятности ρ(r). В этом случае Д. м. 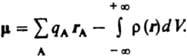 Вектор Д. м. направлен от центра тяжести отрицат. зарядов к центру тяжести положительных. В хим. литературе Д. м. молекулы иногда приписывают противоположное направление. Часто вводят представление о Д. м. отдельных хим. связей, векторная сумма которых дает Д. м. молекулы. При этом Д. м. связи определяют двумя положит. зарядами ядер атомов, образующих связь, и распределением отрицат. (электронного) заряда. Д. м. хим. связи обусловлен смещением электронного облака в сторону одного из атомов. Связь наз. полярной, если соответствующий Д. м. существенно отличается от нуля. Возможны случаи, когда отдельные связи в молекуле полярны, а суммарный Д. м. молекулы равен нулю; такие молекулы наз. неполярными (напр., молекулы CO2 и CCl4). Если же Д. м. молекулы отличен от нуля, молекула наз. полярной. Например, молекула H2O полярна; суммирование Д. м. двух полярных связей OH также дает отличный от нуля Д. м., направленный по биссектрисе валентного угла НОН. Порядок величины Д. м. молекулы определяется произведением заряда электрона (1,6∙10−19 Кл) на длину хим. связи (порядка 10−10 м), т. е. составляет 10−29 Кл∙м. В справочной литературе Д. м. молекул приводят в дебаях (Д или D), по имени П. Дебая; 1 Д = 3,33564∙10−30 Кл∙м. Спектроскопич. методы определения Д. м. молекул основаны на эффектах расщепления и сдвига спектральных линий в электрич. поле (эффект Штарка). Для линейных молекул и молекул типа симметричного волчка известны точные выражения, связывающие Д. м. со штарковским расщеплением линий вращательных спектров. Этот метод дает наиб. точные значения величины Д. м. (до 10−4 Д), причем экспериментально определяется не только величина, но и направление вектора Д. м. Важно, что точность определения Д. м. почти не зависит от его абс. величины. Это позволило получить весьма точные значения очень малых Д. м. ряда молекул углеводородов, которые нельзя надежно определить др. методами. Так, Д. м. пропана равен 0,085 b 0,001 Д, пропилена 0,364 b 0,002 Д, пропина 0,780 b 0,001 Д, толуола 0,375 b 0,01 Д, азулена 0,796 b 0,01 Д. Область применения метода микроволновой спектроскопии ограничена, однако, небольшими молекулами, не содержащими атомов тяжелых элементов. Направление вектора Д. м. молекулы м. б. определено экспериментально и по Зеемана эффекту второго порядка. Др. группа методов определения Д. м. основана на измерениях диэлектрич. проницаемости е вещества. Этими методами измерены Д. м. молекул более 10 тыс. веществ. Переход от измеряемого значения ε газа, чистой жидкости или разбавл. раствора, т. е. макроскопич. характеристики диэлектрика, к величине Д. м. основан на теории поляризации диэлектриков. Считается, что при наложении электрич. поля на диэлектрик его полная поляризация Р (средний Д. м. единицы объема) складывается из наведенной, или индуцированной, поляризации Рм и ориентационной поляризации Рор и связана с m уравнением Ланжевена — Дебая:
Вектор Д. м. направлен от центра тяжести отрицат. зарядов к центру тяжести положительных. В хим. литературе Д. м. молекулы иногда приписывают противоположное направление. Часто вводят представление о Д. м. отдельных хим. связей, векторная сумма которых дает Д. м. молекулы. При этом Д. м. связи определяют двумя положит. зарядами ядер атомов, образующих связь, и распределением отрицат. (электронного) заряда. Д. м. хим. связи обусловлен смещением электронного облака в сторону одного из атомов. Связь наз. полярной, если соответствующий Д. м. существенно отличается от нуля. Возможны случаи, когда отдельные связи в молекуле полярны, а суммарный Д. м. молекулы равен нулю; такие молекулы наз. неполярными (напр., молекулы CO2 и CCl4). Если же Д. м. молекулы отличен от нуля, молекула наз. полярной. Например, молекула H2O полярна; суммирование Д. м. двух полярных связей OH также дает отличный от нуля Д. м., направленный по биссектрисе валентного угла НОН. Порядок величины Д. м. молекулы определяется произведением заряда электрона (1,6∙10−19 Кл) на длину хим. связи (порядка 10−10 м), т. е. составляет 10−29 Кл∙м. В справочной литературе Д. м. молекул приводят в дебаях (Д или D), по имени П. Дебая; 1 Д = 3,33564∙10−30 Кл∙м. Спектроскопич. методы определения Д. м. молекул основаны на эффектах расщепления и сдвига спектральных линий в электрич. поле (эффект Штарка). Для линейных молекул и молекул типа симметричного волчка известны точные выражения, связывающие Д. м. со штарковским расщеплением линий вращательных спектров. Этот метод дает наиб. точные значения величины Д. м. (до 10−4 Д), причем экспериментально определяется не только величина, но и направление вектора Д. м. Важно, что точность определения Д. м. почти не зависит от его абс. величины. Это позволило получить весьма точные значения очень малых Д. м. ряда молекул углеводородов, которые нельзя надежно определить др. методами. Так, Д. м. пропана равен 0,085 b 0,001 Д, пропилена 0,364 b 0,002 Д, пропина 0,780 b 0,001 Д, толуола 0,375 b 0,01 Д, азулена 0,796 b 0,01 Д. Область применения метода микроволновой спектроскопии ограничена, однако, небольшими молекулами, не содержащими атомов тяжелых элементов. Направление вектора Д. м. молекулы м. б. определено экспериментально и по Зеемана эффекту второго порядка. Др. группа методов определения Д. м. основана на измерениях диэлектрич. проницаемости е вещества. Этими методами измерены Д. м. молекул более 10 тыс. веществ. Переход от измеряемого значения ε газа, чистой жидкости или разбавл. раствора, т. е. макроскопич. характеристики диэлектрика, к величине Д. м. основан на теории поляризации диэлектриков. Считается, что при наложении электрич. поля на диэлектрик его полная поляризация Р (средний Д. м. единицы объема) складывается из наведенной, или индуцированной, поляризации Рм и ориентационной поляризации Рор и связана с m уравнением Ланжевена — Дебая:
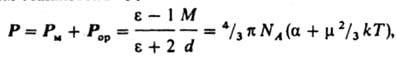
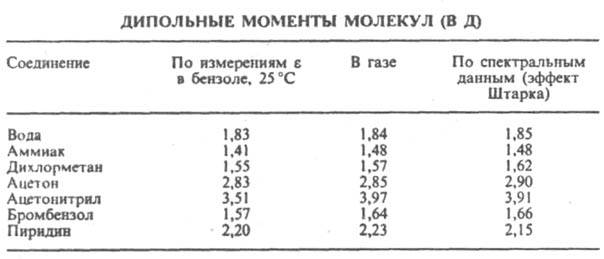
где М — мол. масса, d — плотность, α — поляризуемость молекулы, NA — число Авогадро, k — постоянная Больцмана, Т — абс. температура. Измерения диэлектрич. проницаемости проводят в постоянном поле или при низких частотах, обеспечивающих полную ориентацию молекул по полю. При наиб. распространенном варианте метода — измерениях в разбавл. растворах неполярных растворителей — предполагается аддитивность поляризаций растворенного вещества и растворителя. Сопоставление Д. м. полярных молекул некоторых орг. соед., полученных разными методами, показано в таблице.
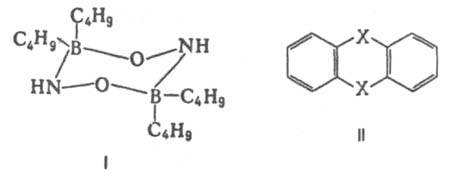
Важнейшая область применения данных о Д. м. молекул — структурные исследования, установление конформации молекул, конформационного и изомерного состава вещества, его зависимости от температуры. Величины Д. м. молекул позволяют судить о распределении электронной плотности в молекулах и зависимости этого распределения от характера отдельных заместителей. В общем случае структурная интерпретация Д. м. требует сравнения эксперим. величин со значениями, полученными квантовомех. расчетом либо при помощи аддитивной векторной схемы с использованием Д. м. отдельных связей и атомных групп. Последние находят либо по интенсивностям колебат. полос поглощения, либо путем векторного разложения Д. м. некоторых симметричных молекул. Расчеты с использованием векторной аддитивной схемы могут учитывать разл. проявления стереохим. нежесткости, напр., затрудненное или своб. внутр. вращение молекулы. Высокосимметричные мол. структуры, обладающие центром инверсии, двумя взаимно перпендикулярными осями вращения или осями, перпендикулярными плоскости симметрии, не должны иметь Д. м. По наличию или отсутствию Д. м. молекулы можно в отдельных случаях выбрать для нее ту или иную структуру без к.-л. теоретич. расчетов. Так, равенство нулю эксперим. Д. м. димера аминооксидибутилборана (формула I) служит доказательством того, что он существует в виде устойчивой кресловидной конформации, обладающей центром инверсии. Наоборот, наличие Д. м. у тиантрена (формула II, X = S) и селенантрена (II, X = Se), равных 1,57 Д и 1,41 Д соотв., исключает для них центросимметричную структуру, в частности плоскую.
Лит.: Минкин В. И., Осипов О. А., Жданов Ю. А., Дипольные моменты в органической химии. Л., 1968; Осипов О. А., Минкин В. И., Гарновский А. Д., Справочник по дипольным моментам, 3 изд.. М., 1971; Exner О., Dipole moments in organic chemistry, Stuttg., 1975.
В. И. Минкин
Значения в других словарях
- ДИПОЛЬНЫЙ МОМЕНТ — Электрический, величина, характеризующая электрич. св-ва системы заряж. ч-ц. Д. м. р электронейтральной системы, состоящей из n заряж. ч-ц, равен: ,где ei—заряд i-той ч-цы, ri; — её радиус-вектор. Д. Физический энциклопедический словарь
- Дипольный момент — Электрический, физическая величина, характеризующая электрические свойства системы заряженных частиц. Д. м. системы из N заряженных частиц равен где ei — заряд частицы номера i, а ri — её радиус-вектор. Д. Большая советская энциклопедия
- ДИПОЛЬНЫЙ МОМЕНТ — ДИПОЛЬНЫЙ МОМЕНТ — физическая величина, характеризующая свойства диполя. Электрический дипольный момент равен произведению положительного заряда электрического диполя на расстояние между зарядами и направлен от отрицательного заряда к положительному. Большой энциклопедический словарь
