глицеральдегидфосфатдегидрогеназа
ГЛИЦЕРАЛЬДЕГИДФОСФАТДЕГИДРОГЕНАЗА [D-глицеральдегид-3-фосфат: НАД оксидоредуктаза (фосфорилирующая)]
фермент класса оксидоредуктаз, катализирующий одну из важнейших реакций гликолиза-фосфорилирование глицеральдег ид-3-фосфата:
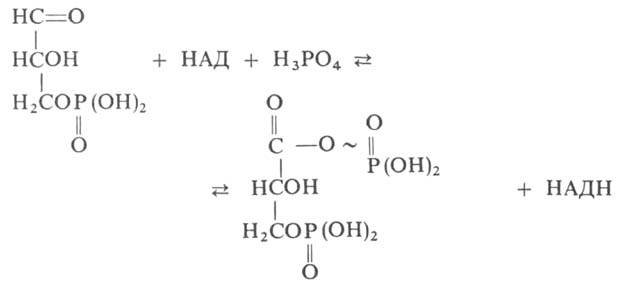
где НАД и НАДН — соотв. окисленная и восстановленная формы кофермента никотинамидадениндинуклеотида. Реакция осуществляется в две стадии: 1) окисление 3-фосфоглицеринового альдегида, сопровождающееся ацилированием группы SH фермента и образованием комплекса Г. с НАДН; 2) перенос 3-фосфоглицерильного остатка на фосфорную кислоту. Энергия, высвобождающаяся на первой стадии, идет на образование макроэргич. связи (обозначена знаком ~) в 1,3-дифосфоглицериновой кислоте.
Молекула Г. состоит из четырех одинаковых субъединиц (мол. масса каждой ок. 40 тыс.), состоящих из двух доменов-связывающего НАД и каталитического. Активный центр локализован на границе между ними и формируется остатками цистеина в положении 149, считая от N-конца субъединицы (образует ковалентное промежут. соед. с субстратом), гистидина 176 (играет роль кислотно-основного катализатора), треонина 181 и 179 (участвуют в связывании остатка фосфорной кислоты). Связь фермента с НАД обусловлена его взаимод. с аспарагиновой кислотой 32 и аргинином 10. Нарушение межсубъединичных контактов не лишает Г. активности: наряду с тетрамером активны также тример, димер и мономер. Субъединицы неэквивалентны в отношении прочности связывания НАД и реакц. способности цистеина 149. Оптим. каталитич. активность Г. из мышц кролика проявляется при pH 8,6–8,9. Изоэлектрич. точка (pI) 8,3.
Г. содержится во всех организмах. На ее долю в мышце приходится ок. 10% от массы всего растворимого белка, а в дрожжах-20%. Ингибиторы Г. — ионы тяжелых металлов, адениловые мононуклеотиды и некоторые ароматич. соед., способные вытеснять НАД из молекулы фермента.
Лит.: М уроне ц В. И. [и др.], "Биохимия", 1982, т. 47, № 6, с. 977–86; Harris Y.L., Waters М., в кн.: Enzymes, 6 ed., ed. by P.D. Boyer, v. 13, N.Y., 1976, p. 1–49; HuangC. Y., RheeS. G., Chock P. B, "Annual Review of Biochemistry",, 1982, v. 51, p. 935–71.
Н. К. Наградова
