галогентионфосфаты
ГАЛОГЕНТИОНФОСФАТЫ
соед. общей формулы (КО)nР(S)На13_n, где п = 1, 2; R = Alk, Ar, циклоалкил, SiAlk3; Hal = F, Cl, Br (соединения с Hal = I неустойчивы). Молекулы Г. имеют форму искаженного тетраэдра. У CH3OP(S)C12 длины связей P=S, P—Cl и Р—О составляют 0,192, 0,2013, 0,1628 нм соотв., углы SPO, SPC1, ОРС1 и С1РС1-115,2, 115,9, 101,4 и 105° соответственно.
Большинство Г. — подвижные бесцветные жидкости (см. табл.); наиболее летучие из них дымят на воздухе. Растворимы в органических растворителях, ограниченно — в воде (с водой, др. веществами, содержащими подвижный атом Н, и окислителями медленно реагируют). Полосы поглощения в ИК-спектрах для связи P=S находятся в области 600–750 см−1
Хим. свойства Г. и их кислородных аналогов (см. галогенфосфаты) во многом сходны. Однако Г. обладают более низкой реакц. способностью, которая при одинаковых R зависит от природы галогена и возрастает в ряду F, C1, Вг. Дигалогенопроизводные обычно более активны, чем моногало гениды.
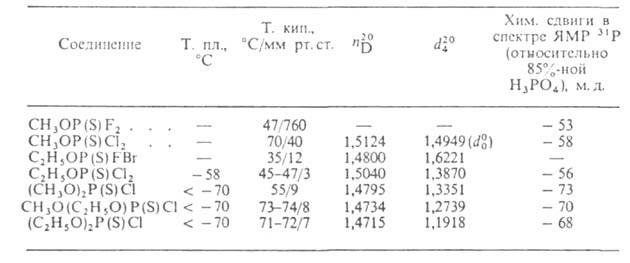
СВОЙСТВА ГАЛОГЕНТИОНФОСФАТОВ
При повыш. температурах многие Г. претерпевают тион-тиольную изомеризацию, напр.:
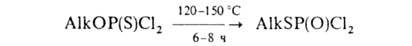
Фторзамещенные Г., диметалхлортионфосфат, некоторые арилгалогентионфосфаты не изомеризуются, т. к. раньше происходит их деструкция.
Реакции Г. со спиртами, фенолами, аминами и др. нуклеофилами обычно проводят с использованием оснований, напр.:
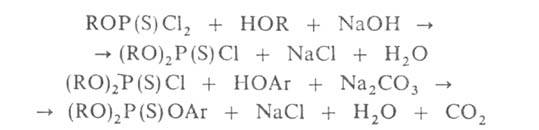
В ряде случаев, особенно при повышенной температуре, возможно образование тиольного изомера конечного продукта.
Г. с низшими алкильными радикалами обладают заметной алкилирующей способностью, напр.:
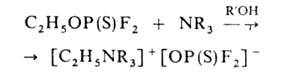
Наиб. значение имеют диалкилхлортионфосфаты. В промышленности их получают: 1) из P2S5:
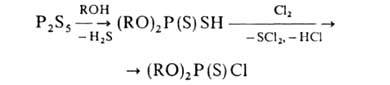
(хорошие выходы продуктов достигаются при удалении H2S из зоны реакции, использовании в качестве растворителя избытка ROH); 2) реакцией PSC13 с алкоголятом Na в спиртовой среде (в этом случае возможно получение диалкилхлортионфосфатов с одинаковыми или разными алкилами, выходы 40–80%). Другие способы синтеза Г. имеют гл. обр. препаративное значение, напр.:
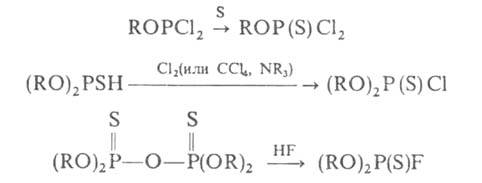
Г. — промежут. продукты в синтезе инсектицидов, напр. базудина и метафоса.
Лит.: Пурдела Д., Вылчану Р., Химия органических соединений фосфора, пер. с рум, М., 1972, с. 433–39; Ail man D., Ma gee R., в кн.: Organic phosporus compounds, v. 1, N.Y., 1976, p. 487–871.
Г. И. Дрозд, И. А. Савина
