внутреннее вращение молекул
ВНУТРЕННЕЕ ВРАЩЕНИЕ МОЛЕКУЛ
вращение фрагментов молекулы относительно друг друга вокруг соединяющей их хим. связи. Обусловливает возникновение разл. конформаций молекулы, характеризуемых определенными значениями потенциальной энергии. Последняя меняется периодически при изменении угла относит. поворота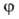 фрагментов молекулы (волчков) и описывается потенциальной функцией внутр. вращения (В. в.)
фрагментов молекулы (волчков) и описывается потенциальной функцией внутр. вращения (В. в.) 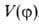 . Максимумы потенциальных кривых (см. рис. 1) соответствуют нестабильным конформациям, минимумы — стабильным. Высота максимума по отношению к соседнему минимуму наз. потенциальным барьером В. в. V0. В зависимости от соотношения значений V0 и тепловой энергии молекул, равной kT (k-постоянная Больцмана, Т — абс. температура в К), различают своб. В. в., когда V0
. Максимумы потенциальных кривых (см. рис. 1) соответствуют нестабильным конформациям, минимумы — стабильным. Высота максимума по отношению к соседнему минимуму наз. потенциальным барьером В. в. V0. В зависимости от соотношения значений V0 и тепловой энергии молекул, равной kT (k-постоянная Больцмана, Т — абс. температура в К), различают своб. В. в., когда V0 k Т (напр., вращение метальных групп в CH3С
k Т (напр., вращение метальных групп в CH3С CCH3), и заторможенное В. в., когда V0
CCH3), и заторможенное В. в., когда V0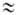 kT (напр., в C2Hб, для которого V0 = 12,5 кДж/моль). При V0
kT (напр., в C2Hб, для которого V0 = 12,5 кДж/моль). При V0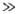 kT В. в. отсутствует, как, напр., в молекуле CH2=CH2 при обычных температурах. При своб. В. в. любые относит. ориентации вращающихся групп (т. е. все конформации) практически равновероятны. При заторможенном В. в. и его отсутствии существуют преим. стабильные конформации, причем в первом случае между ними осуществляются конформа-ционные переходы, а во втором нет. Появление потенциального барьера В. в. вокруг одинарной связи приближенно можно объяснить невалентными взаимод. атомов вращающихся фрагментов, природа которых та же, что и у межмолекулярного взаимодействия. Более строгое объяснение м. б. получено при квантовомех. рассмотрении с использованием неэмпирич. методов.
kT В. в. отсутствует, как, напр., в молекуле CH2=CH2 при обычных температурах. При своб. В. в. любые относит. ориентации вращающихся групп (т. е. все конформации) практически равновероятны. При заторможенном В. в. и его отсутствии существуют преим. стабильные конформации, причем в первом случае между ними осуществляются конформа-ционные переходы, а во втором нет. Появление потенциального барьера В. в. вокруг одинарной связи приближенно можно объяснить невалентными взаимод. атомов вращающихся фрагментов, природа которых та же, что и у межмолекулярного взаимодействия. Более строгое объяснение м. б. получено при квантовомех. рассмотрении с использованием неэмпирич. методов.
Число максимумов (и минимумов) потенциальной функции В.в. для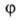 в пределах от 0 до
в пределах от 0 до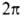 (т. е. кратность барьера
(т. е. кратность барьера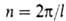 , где l-период функции) зависит от природы атомов, связывающих вращающиеся фрагменты молекулы, числа и кратности образуемых каждым из этих атомов связей и от валентных углов. Так, для молекулы H2O2 барьер двукратный, для C2H6 — трехкратный, для CH3BF2-шестикратный. Чем выше порядок связи, вокруг которой происходит вращение, тем больше величина V0. Общее выражение
, где l-период функции) зависит от природы атомов, связывающих вращающиеся фрагменты молекулы, числа и кратности образуемых каждым из этих атомов связей и от валентных углов. Так, для молекулы H2O2 барьер двукратный, для C2H6 — трехкратный, для CH3BF2-шестикратный. Чем выше порядок связи, вокруг которой происходит вращение, тем больше величина V0. Общее выражение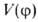 можно представить мат. рядом Фурье:
можно представить мат. рядом Фурье:
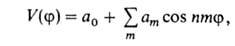
где а0, am — коэф., т= 1,2,3... В случае симметричного трехкратного барьера (напр., когда волчок — группа CH3, имеющая поворотную ось симметрии 3-го порядка C3) п = 3, и при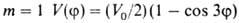 , т. е.
, т. е.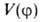 описывает положение минимумов (V=0) и максимумов (V= V0) потенциальной кривой; последующие члены ряда будут уточнять лишь ее форму (крутизну). Решение соответствующей квантовомех. задачи при заданном виде
описывает положение минимумов (V=0) и максимумов (V= V0) потенциальной кривой; последующие члены ряда будут уточнять лишь ее форму (крутизну). Решение соответствующей квантовомех. задачи при заданном виде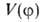 в принципе позволяет найти набор энергетич. уровней для заторможенного В. в. Общий характер уровней энергии для трехкратного барьера показан на рис. 1.
в принципе позволяет найти набор энергетич. уровней для заторможенного В. в. Общий характер уровней энергии для трехкратного барьера показан на рис. 1.
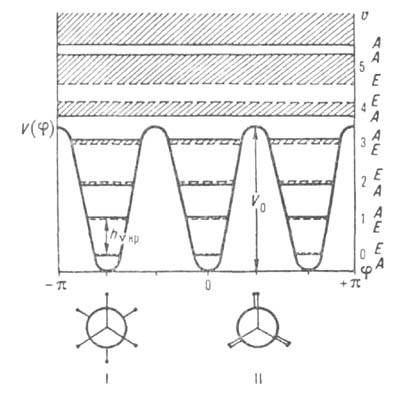
Рис. 1. Потенциальная функция и уровни энергии заторможенного внутр. вращения для молекул, подобных этану. I — стабильные заторможенные (шахматные) конформации, II — заслоненные нестабильные конформации.
Термин "вращение" не является строгим и исчерпывающим. При высоких барьерах в ниж. части потенциальных ям система уровней энергии больше соответствует колебат. характеру движения и м. б. описана даже в приближении гармонического осциллятора: E(v) = hvкр(v + 1/2), где v — колебат. квантовое число, vкр — астота крутильного колебания (т. е. частота перехода; на рис. 1 показан стрелкой). Она связана с V0 приближенной формулой: 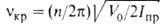 , где Iпр = (I1I2)/(I1 +I2) — приведенный момент инерции (I1 и I2-моменты инерции групп атомов, вращающихся одна относительно другой). Более строгое решение приводит к появлению полносимметричного А и вырожденного ? подуровней, относящихся к данному значению v, причем расщепление, показанное на рис. 1 заштрихованными областями, отражает вращат. характер внутримол. движения. При больших V0 и малых v расщепление А-Е пренебрежимо мало, но по мере приближения к вершине барьера (увеличении v) это расщепление (или роль вращения) возрастает. Выше барьера расстояния между подуровнями А и Е с одним и тем же значением v становятся даже намного больше, чем между заштрихованными областями решений с разными v, т. е. полностью преобладает вращение. При V0
, где Iпр = (I1I2)/(I1 +I2) — приведенный момент инерции (I1 и I2-моменты инерции групп атомов, вращающихся одна относительно другой). Более строгое решение приводит к появлению полносимметричного А и вырожденного ? подуровней, относящихся к данному значению v, причем расщепление, показанное на рис. 1 заштрихованными областями, отражает вращат. характер внутримол. движения. При больших V0 и малых v расщепление А-Е пренебрежимо мало, но по мере приближения к вершине барьера (увеличении v) это расщепление (или роль вращения) возрастает. Выше барьера расстояния между подуровнями А и Е с одним и тем же значением v становятся даже намного больше, чем между заштрихованными областями решений с разными v, т. е. полностью преобладает вращение. При V0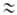 О квантовомех. задача решается так же, как для своб. ротатора:
О квантовомех. задача решается так же, как для своб. ротатора: 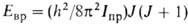 , где J — вращательное квантовое число.
, где J — вращательное квантовое число.
При отсутствии осевой симметрии волчков, напр. в молекулах 1,2-дизамещенных этана, заторможенное В. в. приводит к явлению поворотной изомерии, представляющей собой частный случай конформационной изомерии (см. конформационный анализ), когда устойчивым конформациям соответствуют разные по глубине минимумы потенциальной энергии, т. е. возникают различающиеся по форме и свойствам поворотные изомеры (конформеры). В частности, у молекул типа 1,2-дизамещенных этана имеются три стабильных конформации — одна транс- (или анти-) и две гош-конформации (см. рис. 2). Относит. стабильность поворотных изомеров определяется разностью их энергий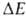 , т. е. разностью значений энергии в минимумах потенциальной кривой. Например, транс-изомер 1,2-дихлорэтана более устойчив, чем гош-изомер, т. к. его энергия (в газовой фазе) ниже на ~ 5,6 кДж/моль. При достаточно низких потенциальных барьерах (неск. десятков кДж/моль) поворотные изомеры находятся в термодинамич. равновесии, положение которого зависит от температуры, давления и природы среды. Для барьеров порядка Ш кДж/моль время жизни конформеров составляет ~10−10с. При высоких значениях VQ (выше ~ 100 кДж/моль), когда В. в. отсутствует, конформеры даже при малой разности их энергий могут существовать как индивидуальные вещества. В. в. молекул возможно в газовой и жидкой фазах, параметры
, т. е. разностью значений энергии в минимумах потенциальной кривой. Например, транс-изомер 1,2-дихлорэтана более устойчив, чем гош-изомер, т. к. его энергия (в газовой фазе) ниже на ~ 5,6 кДж/моль. При достаточно низких потенциальных барьерах (неск. десятков кДж/моль) поворотные изомеры находятся в термодинамич. равновесии, положение которого зависит от температуры, давления и природы среды. Для барьеров порядка Ш кДж/моль время жизни конформеров составляет ~10−10с. При высоких значениях VQ (выше ~ 100 кДж/моль), когда В. в. отсутствует, конформеры даже при малой разности их энергий могут существовать как индивидуальные вещества. В. в. молекул возможно в газовой и жидкой фазах, параметры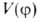 зависят от характера среды и электронного состояния молекулы. В кристаллах В. в., как правило, отсутствует и стабилен лишь один конформер; иногда существуют твердые фазы (напр., у некоторых фреонов), в которых стабильны разные конформеры и между ними осуществляются переходы.
зависят от характера среды и электронного состояния молекулы. В кристаллах В. в., как правило, отсутствует и стабилен лишь один конформер; иногда существуют твердые фазы (напр., у некоторых фреонов), в которых стабильны разные конформеры и между ними осуществляются переходы.
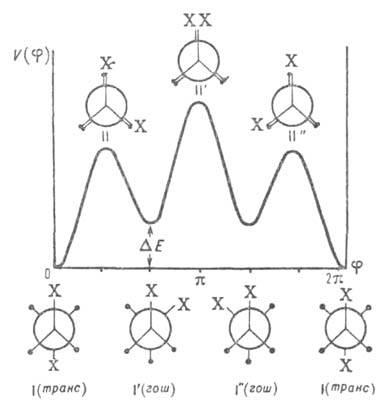
Рис. 2. Потенциальная функция внутр. вращения молекул типа 1,2-дизамешенного этана. I-I''-поворотные изомеры (конформеры), или стабильные заторможенные конформации, II-II"-нестабильные заслоненные конформации.
Явления заторможенного В. в. и поворотной изомерии молекул оказывают влияние на термодинамич., электрич., оптич. и др. свойства веществ. В. в. необходимо учитывать при расчете термодинамич. функций методами статистич. термодинамики. Например, для CH3SH опытное значение энтропии 5^79 12 = 251,7 Дж/(моль∙К), а расчетное (без учета В. в.) на 8,4 Дж/(моль∙К) меньше. С др. стороны, если исходить из предположения о свободном В. в., расчетная величина S0279,12 превышает опытную на 2,0 Дж/(моль∙К); следовательно, в молекуле CH3SH существует заторможенное В. в. вокруг связи С—S.
В случае поворотной изомерии свойства вещества Определяются как свойства равновесной смеси изомеров и зависят от внеш. условий, влияющих на положение равновесия. Например, эффективный дипольный момент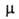 зависит от температуры. Если
зависит от температуры. Если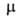 поворотных изомеров различны, как, напр., у транс- (
поворотных изомеров различны, как, напр., у транс- (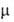 = 0) и гош-
= 0) и гош-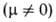 конформеров 1,2-дихлорэтана, то при изменении температуры значение измеряемого
конформеров 1,2-дихлорэтана, то при изменении температуры значение измеряемого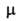 будет приближаться к значению, характерному для изомера, концентрация которого будет при этом возрастать.В жидкой фазе и в среде полярных растворителей повышается устойчивость более полярного гош-изомера в результате взаимод. молекул растворителя и растворенного вещества. Поворотные изомеры, имея разл. равновесные конфигурации, различаются своими колебат. и вращат. спектрами. При увеличении числа осей В. в. в молекуле возрастает и число ее возможных конформаций.
будет приближаться к значению, характерному для изомера, концентрация которого будет при этом возрастать.В жидкой фазе и в среде полярных растворителей повышается устойчивость более полярного гош-изомера в результате взаимод. молекул растворителя и растворенного вещества. Поворотные изомеры, имея разл. равновесные конфигурации, различаются своими колебат. и вращат. спектрами. При увеличении числа осей В. в. в молекуле возрастает и число ее возможных конформаций.
Представления, связанные с В. в. и поворотной изомерией молекул, применяют в теории строения как низкомол., так и высокомол. соединений. Разработаны методы и схемы конформационных расчетов достаточно сложных молекулярных систем на основе мех. моделей, получили также развитие полуэмпирич. и неэмпирич. квантовомех. расчеты потенциальных функций В. в. молекул. Для изучения явлений В. в. и поворотной изомерии молекул используют методы спектроскопии: ИК, комбинац. рассеяния, микроволновой, УФ, ЯМР, ЭПР, а также методы газовой электронографии, поглощения ультразвука, некогерентного, неупругого рассеяния нейтронов, измерения дипольных моментов, диэлектрич. потерь и др.
Лит.: МидзусимаС, Строение молекул и внутреннее вращение, пер. с англ., М., 1957; Волькенштейн М.В., Конфигурационная статистика полимерных цепей, М.-Л., 1959; Пентин Ю. А., Вращательная изомерия молекул, М., 1969; Внутреннее вращение молекул, под ред. В.Дж. Орвилл-Томаса, пер. с англ., М., 1977.
Ю. А. Пентин
