бария фторид
БАРИЯ ФТОРИД BaF2
бесцветные кристаллы. До 970 °C устойчива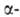 фаза с кубич. кристаллической решеткой типа флюорита (а = 0,62001 нм, 2 = 4, пространственная группа Fm3m); плотн. 4,893 г/см3; при 970 °C переходит в разупорядоченную фазу (
фаза с кубич. кристаллической решеткой типа флюорита (а = 0,62001 нм, 2 = 4, пространственная группа Fm3m); плотн. 4,893 г/см3; при 970 °C переходит в разупорядоченную фазу (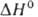 перехода 5,4 кДж/моль), при 1207 °C — в
перехода 5,4 кДж/моль), при 1207 °C — в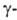 фазу (
фазу (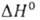 перехода 2,5 кДж/моль). Т. пл. 1368 °C, т. кип. ок. 2250 °C; C0p 71,0 Дж/(моль∙К);
перехода 2,5 кДж/моль). Т. пл. 1368 °C, т. кип. ок. 2250 °C; C0p 71,0 Дж/(моль∙К); 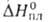 17,5 кДж/моль;
17,5 кДж/моль; 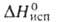 271 кДж/моль,
271 кДж/моль, 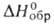 −1187 кДж/моль,
−1187 кДж/моль, 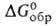 −1136 кДж/моль; S$98 96,4 Дж/(моль∙К)). Уравнения температурной зависимости давления пара над твердым и жидким BaF2 соотв.: lgр(Па)=12,67-18699/Т; lgp(Ha) = = 30,15 — 20100/T — 5,031 lg Т (2061
−1136 кДж/моль; S$98 96,4 Дж/(моль∙К)). Уравнения температурной зависимости давления пара над твердым и жидким BaF2 соотв.: lgр(Па)=12,67-18699/Т; lgp(Ha) = = 30,15 — 20100/T — 5,031 lg Т (2061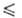 Т
Т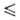 2206 К). Плохо раств. в воде (1,607 г/л при 20 °C), лучше — в водных растворах HF, не раств. в органических растворителях. Выше 500 °C гидролизуется парами воды; с HF способен образовывать термически неустойчивые гидрофториды. Б. ф. встречается в природе в виде редкого минерала франкдиксонита. Получают взаимод. BaCO3 с HF, NH4HF2 или их водными растворами. Б.ф. — компонент стекол, эмалей, флюсов, защитных покрытий на металлах, материал для_ ИК-оптики и лазеров (прозрачен в области 71430–833 см−1); сорбент при очистке UF6. Б.ф. токсичен; ПДК 1 мг/м3 (в пересчете на HF).
2206 К). Плохо раств. в воде (1,607 г/л при 20 °C), лучше — в водных растворах HF, не раств. в органических растворителях. Выше 500 °C гидролизуется парами воды; с HF способен образовывать термически неустойчивые гидрофториды. Б. ф. встречается в природе в виде редкого минерала франкдиксонита. Получают взаимод. BaCO3 с HF, NH4HF2 или их водными растворами. Б.ф. — компонент стекол, эмалей, флюсов, защитных покрытий на металлах, материал для_ ИК-оптики и лазеров (прозрачен в области 71430–833 см−1); сорбент при очистке UF6. Б.ф. токсичен; ПДК 1 мг/м3 (в пересчете на HF).
