барий
БАРИЙ (от греч. barys — тяжелый; лат. Barium) Ba
хим. элемент II гр. периодической системы, ат. н. 56, ат. м. 137,33; относится к щелочноземельным элементам. Прир. Б. состоит из семи стабильных изотопов с мас. ч. 130, 132, 134–137 и 138 (71,66%). Поперечное сечение захвата тепловых нейтронов 1,17∙1028 м2. Конфигурация внеш. электронной оболочки 6s2; степень окисления + 2, редко + 1; энергия ионизации Ва° → Ва+ → Ва2+ соотв. 5,21140 и 10,0040 эВ; электроотрицательность по Полингу 0,9; атомный радиус 0,221 нм, ионный радиус Ва2+ 0,149 нм (координационное число 6).
Содержание Б. в земной коре 5∙10−2% по массе. В своб. виде не встречается. Важнейшие минералы — барит (тяжелый, или персидский, шпат) BaSO4, наиб. крупные месторождения которого находятся в СССР, США, Франции, Румынии, и витерит BaCO3. Разведанные запасы барита ок. 115 млн. т, общие запасы — ок. 300 млн, т (1980).
Свойства. Б. — серебристо-белый ковкий металл. При резком ударе раскалывается. При обычном давлении существует в двух аллотропных модификациях: до 375 °C устойчив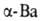 с кубической объемно-центриров. решеткой (а = = 0,501 нм), выше 375 °C устойчив
с кубической объемно-центриров. решеткой (а = = 0,501 нм), выше 375 °C устойчив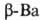 ;
; 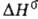 перехода 0,86 кДж/моль. При 19 °C и 5530 МПа образуется гексаген, модификация. Т. пл. 727 °C, т. кип. 1637 °C; плотн. 3,780 г/см3; тройная точка: температура 710 °C, давл. 1,185 Па; уравнения температурной зависимости давления пара над твердым и жидким Б. соотв.: 1g р (мм рт. ст.) = 9,405 — 9496/Г --0,787∙10−3 T — 0,3641g T (298-983К), 1gр( мм рт. ст.) = = 20,408 — 8304/Г — 4,036lg T (983 — 1959 К); tкрит 2497 °C; C0p 28,1 Дж/(моль∙К);
перехода 0,86 кДж/моль. При 19 °C и 5530 МПа образуется гексаген, модификация. Т. пл. 727 °C, т. кип. 1637 °C; плотн. 3,780 г/см3; тройная точка: температура 710 °C, давл. 1,185 Па; уравнения температурной зависимости давления пара над твердым и жидким Б. соотв.: 1g р (мм рт. ст.) = 9,405 — 9496/Г --0,787∙10−3 T — 0,3641g T (298-983К), 1gр( мм рт. ст.) = = 20,408 — 8304/Г — 4,036lg T (983 — 1959 К); tкрит 2497 °C; C0p 28,1 Дж/(моль∙К); 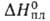 7,12 кДж/моль,
7,12 кДж/моль, 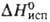 150,9 кДж/моль (1910 К); S0298 62,5 Дж/(моль∙К); температурный коэф. линейного расширения (17–21)∙10−б К−1 (273–573 Ю;
150,9 кДж/моль (1910 К); S0298 62,5 Дж/(моль∙К); температурный коэф. линейного расширения (17–21)∙10−б К−1 (273–573 Ю; 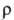 _6∙10−8 Ом∙м (273 К), температурный коэф.
_6∙10−8 Ом∙м (273 К), температурный коэф.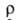 3,6∙10−3 К−1. Б. парамагнитен, магн. восприимчивость 0,15∙109. Работа выхода электрона 2,49 эВ. Стандартный электродный потенциал Ва2+/Ва — 2,906 В. Твердость по минералогич. шкале 1,25, по шкале Мооса 2, по Бринеллю 42 МПа; коэф. сжимаемости 10,4∙1011 Па−1; 12,8–0,98 МПа (293–873 К).
3,6∙10−3 К−1. Б. парамагнитен, магн. восприимчивость 0,15∙109. Работа выхода электрона 2,49 эВ. Стандартный электродный потенциал Ва2+/Ва — 2,906 В. Твердость по минералогич. шкале 1,25, по шкале Мооса 2, по Бринеллю 42 МПа; коэф. сжимаемости 10,4∙1011 Па−1; 12,8–0,98 МПа (293–873 К).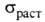
Б. интенсивно окисляется на воздухе, образуя пленку, содержащую бария оксид BaO и нитрид Ba3N2 (т. пл. ~ 1000 °C). При незначит. нагревании на воздухе воспламеняется. Энергично реагирует с водой, давая бария гидроксид Ba(OH)2. С разб. кислотами образует соли. Большинство солей Б. с анионами слабых кислот и кислот средней силы малорастворимы, исключение — BaS, Ba(CN)2, Ba(SCN)2, Ba(OOCCH3)2. С галогенами Б. образует галогениды, с H2 при нагр. — гидрид ВаH2 [т. пл. 675 °C (с разл.), плотн. 4,15 г/см3, 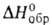 −190,1 кДж/моль], с NH3 при нагр. — ВаH2 и Ba3N2, с С и N2 — цианид Ba(CN)2. С жидким NH3 дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присут. платинового кат. аммиакат разлагается с образованием амида Б.:
−190,1 кДж/моль], с NH3 при нагр. — ВаH2 и Ba3N2, с С и N2 — цианид Ba(CN)2. С жидким NH3 дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присут. платинового кат. аммиакат разлагается с образованием амида Б.:
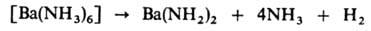
Б. восстанавливает оксиды, галогениды и сульфиды мн. металлов до соответствующего металла. Для него характерно образование интерметаллидов, напр. в системе Ba — А1 обнаружены BaAl, ВаAl2, ВаAl4.
Наиб. практически важным сое д. Б. (в частности, оксиду, сульфату, фториду, хлориду) посвящены спец. статьи. Ниже приводятся сведения о некоторых других соед. этого элемента.
Сульфид BaS — бесцветные кристаллы; т. пл. 2200 °C; плотн. 4,25 г/см3; 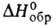 −453 кДж/моль; раств. в воде (в 100г-7,86 г при 20 °C, 67,34 г при 90 °C), практически не раств. в спирте. Из раствора кристаллизуется гексагидрат, обезвоживающийся при 170 °C. При растворении BaS частично гидролизуется до Ba(SH)2 и Ba(OH)2; растворы медленно окисляются кислородом воздуха с образованием S. При хранении на воздухе BaS поглощает CO2, образуя BaCO3 и H2S, при прокаливании на воздухе окисляется до BaSO4. BaS — промежут. продукт при получении Б. Его применяют в производстве BaCl2 и других соед. Б., в кожевенной промышленности для удаления волосяного покрова со шкур.
−453 кДж/моль; раств. в воде (в 100г-7,86 г при 20 °C, 67,34 г при 90 °C), практически не раств. в спирте. Из раствора кристаллизуется гексагидрат, обезвоживающийся при 170 °C. При растворении BaS частично гидролизуется до Ba(SH)2 и Ba(OH)2; растворы медленно окисляются кислородом воздуха с образованием S. При хранении на воздухе BaS поглощает CO2, образуя BaCO3 и H2S, при прокаливании на воздухе окисляется до BaSO4. BaS — промежут. продукт при получении Б. Его применяют в производстве BaCl2 и других соед. Б., в кожевенной промышленности для удаления волосяного покрова со шкур.
Ацетат Ва(OOCCH3), — бесцветные кристаллы; т. пл. 490 °C (с разл.); плотн. 2,47 г/см3; раств. в воде (58,8 г в 100 г при 0 °C). Ниже 25 °C из водных растворов кристаллизуется тригидрат, при 25–41 °C — моногидрат, выше 41 °C — безводная соль. Получают взаимод. Ba(OH)2, BaCO3 или BaS с CH3CO2Н. Применяют как протраву при крашении шерсти и ситца.
Манганат(VI) ВаMnO4 — зеленые кристаллы; не разлагается до 1000 °C. Получают прокаливанием смеси Ba(NO3)2 с MnO2. Пигмент (касселева, или марганцовая, зелень), обычно используемый для фресковой живописи.
Хромат(VI) BaCrO4 — желтые кристаллы; т. пл. 1380 °C; 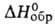 −1366,8 кДж/моль; раств. в неорг. кислотах, не раств. в воде. Получают взаимод. водных растворов Ba(OH)2 или BaS с хроматами(VI) щелочных металлов. Пигмент (баритовый желтый) для керамики. ПДК 0,01 мг/м3 (в пересчете на Cr03). Пирконат ВаZrO3 — бесцветные кристаллы; т. пл. ~269 °C;
−1366,8 кДж/моль; раств. в неорг. кислотах, не раств. в воде. Получают взаимод. водных растворов Ba(OH)2 или BaS с хроматами(VI) щелочных металлов. Пигмент (баритовый желтый) для керамики. ПДК 0,01 мг/м3 (в пересчете на Cr03). Пирконат ВаZrO3 — бесцветные кристаллы; т. пл. ~269 °C; 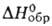 −1762 кДж/моль; раств. в воде и водных растворах щелочей и NH4HCO3, разлагается сильными неорг. кислотами. Получают взаимод. ZrO2 с BaO, Ba(OH)2 или BaCO3 при нагревании. Цирконат Ba в смеси с ВаTiO3-пьезоэлектрик.
−1762 кДж/моль; раств. в воде и водных растворах щелочей и NH4HCO3, разлагается сильными неорг. кислотами. Получают взаимод. ZrO2 с BaO, Ba(OH)2 или BaCO3 при нагревании. Цирконат Ba в смеси с ВаTiO3-пьезоэлектрик.
Бромид ВаBr2 — белые кристаллы; т. пл. 847 °C; плотн. 4,79 г/см3; 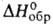 −757 кДж/моль; хорошо раств. в воде, метаноле, хуже — в этаноле. Из водных растворов кристаллизуется дигидрат, превращающийся в моногидрат при 75 °C, в безводную соль — выше 100 °C В водных растворах взаимод. с CO2 и O2 воздуха, образуя BaCO3 и Br2. Получают ВаBr2 взаимод. водных растворов Ba(OH)2 или BaCO3 с бромистоводородной кислотой.
−757 кДж/моль; хорошо раств. в воде, метаноле, хуже — в этаноле. Из водных растворов кристаллизуется дигидрат, превращающийся в моногидрат при 75 °C, в безводную соль — выше 100 °C В водных растворах взаимод. с CO2 и O2 воздуха, образуя BaCO3 и Br2. Получают ВаBr2 взаимод. водных растворов Ba(OH)2 или BaCO3 с бромистоводородной кислотой.
Иодид ВаI2 — бесцветные кристаллы; т. пл. 740 °C (с разл.); плотн. 5,15 г/см3; 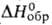 . −607 кДж/моль; хорошо раств. в воде и этаноле. Из горячих водных растворов кристаллизуется дигидрат (обезвоживается при 150 °C), ниже 30 °C — гексагидрат. Получают ВаI2 взаимод. водных растворов Ba(OH)2 или BaCO3 с иодистоводородной кислотой.
. −607 кДж/моль; хорошо раств. в воде и этаноле. Из горячих водных растворов кристаллизуется дигидрат (обезвоживается при 150 °C), ниже 30 °C — гексагидрат. Получают ВаI2 взаимод. водных растворов Ba(OH)2 или BaCO3 с иодистоводородной кислотой.
Получение. Осн. сырье в производстве Б. и его соед. — баритовый концентрат (80–95% BaSO4), который получают флотацией барита с использованием жидкого стекла в качестве депрессора пустой породы; степень извлечения BaSO4 — 55–60%. Восстановлением BaSO4 каменным углем, коксом или прир. газом получают BaS (BaSO4 + 4С → BaS + 4СО; BaSO4 + 2CH4 → BaS + 2C + 4H2O), который перерабатывают на другие соед. Б., в частности Ba(OH)2, BaCO3 и Ba(NO3)2. Прокаливанием этих соединений соотв. при 800, 1400 и 700 °C получают BaO.
Осн. пром. метод получения металлич. Б. из BaO — восстановление его порошком А1: 4BaO + 2А1 → ЗВа + BaO*Al2O3. Процесс проводят в реакторе при 1100–1200 °C в атмосфере Ar или в вакууме (последний способ предпочтителен). Молярное соотношение BaO:А1 составляет (1,5–2):1. Реактор помещают в печь так, чтобы температура его "холодной части" (в ней конденсируются образующиеся пары Б.) была ок. 520 °C Перегонкой в вакууме Б. очищают до содержания примесей менее 10~4% по массе, а при использовании зонной плавки — до 10~6%.
Небольшие количества Б. получают также восстановлением ВаBeO2 [синтезируемого сплавлением Ba(OH)2 и Ве(OH)2] при 1300 °C титаном, а также разложением при 120 °C Ba(N3)2, образующегося при обменных реакциях солей Б. с NaN3.
Определение. Из водных растворов солей Б. осаждается вместе с Ca и Sr при действии (NH4)2CO3. От Ca и Sr барий отделяют в виде BaCrO4 в присутствии CH3CO2Н либо в виде BaSO4 благодаря его очень низкой растворимости в неорг. кислотах. Обнаруживают Б. по желто-зеленому окрашиванию пламени (длина волны 455 и 493 нм) и по розовому окрашиванию раствора родизоната Na. Количественно Б. определяют гравиметрически в виде BaSO4 [осадители — H2SO4, (NH4)2S04, H2NS02OH, (CH3)2SOJ, в присутствии Ca и Sr — в виде BaCrO4 (получаемого осаждением K2Cr2O7 из уксуснокислых растворов). Б. определяют также титриметрически с применением комплексона III при pH 10 и эриохрома черного Т в качестве индикатора и фотометрически с использованием ортонилового С при pH 2–8 в водно-спиртовом или водно-ацетоновом растворе (длина волны окрашенного комплекса 640 нм). Для экспресс-анализа прир. минералов, руд и др. используют рентгенофлуоресцентный метод (источники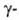 излучения — 170Тm, 241Ат с активностью 5–6 Кюри; эмиссионная линия Б.
излучения — 170Тm, 241Ат с активностью 5–6 Кюри; эмиссионная линия Б.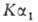 при 0,386 °C).
при 0,386 °C).
Применение. Сплав Б. с А1 (сплав альба, 56% Ва) — основа геттеров (газопоглотителей). Для получения собственно геттера Б. испаряют из сплава высокочастотным нагревом в вакуумированной колбе прибора, в результате на холодных частях колбы образуется т. наз. бариевое зеркало (или диффузное покрытие при испарении в среде азота). Активной частью подавляющего большинства термоэмиссионных катодов является BaO. Б. используют также как раскислитель Cu и Pb, в качестве присадки к антифрикц. сплавам, черным и цветным металлам, а также к сплавам, из которых изготавливают типографские шрифты для увеличения их твердости. Сплавы Б. с Ni служат для изготовления электродов запальных свечей в двигателях внутр. сгорания и в радиолампах. 140Ва (T1/2 12,8 дней) — изотопный индикатор, используемый при исследовании соединений Б.
Мировое производство (без СССР) барита 7,3 млн. т, др. соед. Ba — 0,70–0,75 млн. т (1980). Металлич. Б. хранят в керосине, под слоем парафина, сплавы — в герметичной металлич. упаковке в атмосфере азота. Б. открыт в виде BaO в 1774 К. Шееле, металлич. Б. впервые получен в 1808 Г. Дэви.
Лит.: АхметовТ.Г., Химия и технология соединений бария М., 1974; Фрумина Н. С., Горюнова Н. Н., Еременко С. Н., Аналитическая химия бария, М., 1977.
Н. А. Иофис, Б. Г. Иофис
Значения в других словарях
- барий — -я, м. Химический элемент, мягкий металл серебристого цвета. [От греч. βαρύς — тяжелый] Малый академический словарь
- Барий — (лат. Baryum) Ba, химический элемент II группы периодической системы Менделеева, атомный номер 56, атомная масса 137,34; серебристо-белый металл. Состоит из смеси 7 стабильных изотопов, среди которых преобладает 138Ba (71,66%). Большая советская энциклопедия
- барий — орф. барий, -я Орфографический словарь Лопатина
- барий — Ба́р/ий/. Морфемно-орфографический словарь
- Барий — (Barium) химический элемент II группы периодической системы элементов Д.И. Менделеева, ат. номер 56, ат. масса 137,34; принадлежит к числу микроэлементов и содержится во всех органах и тканях; растворимые соли... Медицинская энциклопедия
- БАРИЙ — БАРИЙ (символ Ва), серебристо-белый металл, один из элементов из группы щелочноземельных металлов, открытый в 1808 г. сэром Хэмфри Дэви. Это мягкий металл, основным источником которого является барит (сульфат бария) и витерит (карбонат бария). Научно-технический словарь
- Барий — Ва (лат. Baryum, от греч. bаrys — тяжёлый * a. barium; н. Barium; ф. barium; и. bario), — хим. элемент главной подгруппы 11 группы периодич. системы элементов Менделеева, ат. н. 56, ат. м. 137,33. Природный... Горная энциклопедия
- барий — БАРИЙ -я; м. [лат. Barium от греч. barys — тяжёлый]. 1. Химический элемент (Ba), мягкий серебристо-белый химически активный металл (применяется в технике, промышленности, медицине). 2. Разг. Толковый словарь Кузнецова
- барий — БАРИЙ, я, м. Химический элемент, мягкий металл серебристого цвета. | прил. бариевый, ая, ое. Толковый словарь Ожегова
- барий — Б’АРИЙ, бария, мн. нет, ·муж. (от ·греч. barys — тяжелый) (·хим. ). Мягкий металл золотисто-желтого цвета. Толковый словарь Ушакова
- Барий — I (хим. обозн. Ва, атомный вес 137) принадлежит к группе щелочноземельных металлов и по своим свойствам в особенности близок к кальцию и стронцию. Энциклопедический словарь Брокгауза и Ефрона
- барий — барий м. 1. Химический элемент, мягкий серебристо-белый металл, соединения которого применяются в промышленности и медицине. 2. разг. Соль этого элемента, используемая в рентгенологии. Толковый словарь Ефремовой
- БАРИЙ — БАРИЙ (лат. Barium) — Ba, химический элемент II группы периодической системы, атомный номер 56, атомная масса 137,33, относится к щелочноземельным металлам. Название от греч. barys — тяжелый. Большой энциклопедический словарь
- барий — Бария, мн. нет, м. [от греч. barys – тяжелый] (хим.). Мягкий металл золотисто-желтого цвета. Большой словарь иностранных слов
