аккумуляторы
АККУМУЛЯТОРЫ электрические (от лат. accumulator — собиратель, накопитель)
хим. источники тока многократного действия. При заряде от внеш. источника электрич. тока в А. накапливается энергия, которая при разряде вследствие хим. реакции непосредственно превращ. снова в электрическую и выделяется во внеш. цепь. По принципу работы и осн. элементам конструкции А. не отличаются от гальванических элементов, но электродные реакции, а также суммарная токообразующая реакция в А. обратимы. Поэтому после разряда А. может быть снова заряжен пропусканием тока в обратном направлении: на положит. электроде при этом образуется окислитель, на отрицательном-восстановитель.
Наиб. распространены свинцовые А., часто наз. также кислотными. Их действие основано на реакции:
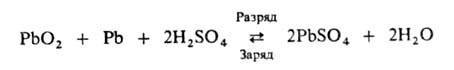
Электролит — раствор H2SO4 с концентрацией 12–24% по массе в разряженном состоянии и 28–40% в заряженном. Напряжение разомкнутой цепи (НРЦ) 1,95–2,15 В. Чаще всего применяют электроды из пасты, содержащей смесь Pb3O4 и PbO с H2SO4 (активная масса); эту пасту намазывают на профилированную сетку-токоотвод из сплава Pb с 2–12% Sb. Электроды формируют, пропуская через раствор электролита зарядный ток в определенном режиме; при этом на одном электроде образуется PbO2, на другом-Pb. Затем электроды отмывают и сушат в условиях, исключающих возможность окисления Pb. А., собранные из таких электродов, после заливки у потребителя раствором H2SO4 готовы к эксплуатации без подзаряда (остальные виды А. требуют дополнит. заряда). Применяют также панцирные электроды, в которых активная масса заключена в перфорированную пластмассовую или тканевую трубку.
Первый свинцовый А. был создан Г. Планте в 1859. Сейчас более половины мирового производства Pb расходуется на изготовление свинцовых А. с единичной емкостью 2–5000 А * ч и уд. энергией 25–40 Вт * ч/кг. Осн. достоинства таких А.: относит. дешевизна, пологие разрядная и зарядная кривые, возможность работать в разл. режимах разряда; недостаток — невысокий ресурс работы (число допустимых циклов заряд-разряд для стартерных А. 100–300, для тяговых с панцирными электродами 800–1500). В конце заряда на электродах свинцового А. наблюдается заметное выделение газов, которые часто увлекают за собой туман из капель H2SO4. В связи с этим большое внимание уделяется созданию герметизированных свинцовых А.
Щелочные никель-кадмиевые (НКА) и никельжелезные (НЖА) А. по распространению занимают второе место после свинцовых. Токообразующая реакция:
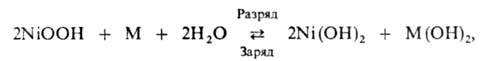
где M-Cd или Fe. Электролит-водный раствор КОН, в который иногда вводят LiOH для улучшения работоспособности окисноникелевого электрода. НРЦ составляет 1,30–1,34 В для НКА и 1,37–1,41 В для НЖА (спустя некоторое время после окончания заряда), уд. энергия 20–35 Вт∙ч/кг. Щелочные А. имеют, как правило, высокий ресурс — 1–2 тыс. циклов. Электроды м. б. разл. конструкции: ламельные, в которых активная масса заключена в плоские коробочки-ламели из перфорированной стальной ленты; спеченные, в которых активная масса вводится в поры основы, образуемой при спекании порошкообразного металлич. Ni; прессованные, в которых активную массу под давл. 35–60 МПа напрессовывают на стальную основу (толщина пластин 0,8–1,8 мм).
НЖА используют в осн. для изготовления тяговых аккумуляторных батарей большой емкости (до 1200 А * ч). Они дешевле НКА, но характеризуются повыш. саморазрядом из-за коррозии железа в щелочном растворе; кроме того, у них более низкие значения отдачи по току и по энергии. В НКА не наблюдается коррозии Cd и связанного с ней газовыделения, что обусловливает большую длительность сохранения заряженного состояния и возможность полной герметизации А. Герметичные НКА выпускают емкостью от 0,01 до 160 А * ч. Их широко используют как источники электрич. энергии в приборах бытовой техники, средствах связи и т. п.
Серебряно-цинковые А. со щелочным электролитом имеют высокую уд. энергию (до 130 Вт∙ч/кг) и способны разряжаться большими токами, но из-за высокой стоимости серебра нашли применение только в специальных отраслях, напр. в космической технике. Токообразующая реакция:
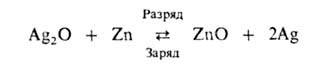
При заряде возможно также образование AgO. Поэтому на зарядных и разрядных кривых наблюдаются ступени, соответствующие реакциям с участием Ag2O и AgO. НРЦ 1,60–1,85 В, ресурс не превышает 100–200 циклов.
Попытки замены Ag др. материалами привели к созданию никель-цинковых А., в которых используют спеченный или прессованный окисноникелевый электрод от НКА и цинковый электрод от серебряно-цинковых А. Токообразующая реакция:
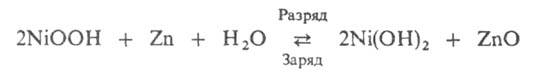
НРЦ 1,74–1,78 В, уд. энергия ок. 60 Вт∙ч/кг, ресурс ок. 300 циклов. Разрабатываемые варианты этих А. предназначены в осн. для электромобилей, но широкому использованию их мешает недостаточный пока ресурс работы.
В никель-водородных А. протекает след. токообразующая реакция:
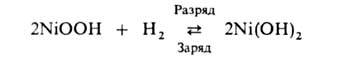
Выделяющийся при заряде H2 накапливается под давлением. Поэтому блок с электродами помещают в стальной цилиндр, выдерживающий давления до 10 МПа. НРЦ 1,32–1,36 В, уд. энергия 50–60 Вт∙ч/кг, ресурс неск. тысяч циклов. Из-за дороговизны производства такие А. применяют пока только в космич. технике.
Среди перспективных конструкций А. с неводными электролитами наиб. интерес представляют серно-натриевые с твердым керамич. электролитом из алюминатов натрия, обладающим проводимостью по ионам Na+. Рабочая температура такого А. 300–350 °C. Токообразующая реакция:
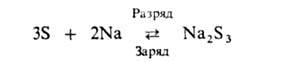
НРЦ 2,08 В. Осн. трудность при разработке: создание технологии изготовления тонких, но достаточно стойких деталей из твердого электролита. Разрабатывают также высокотемпературные сульфид-железо-литиевые А.; в них вместо твердого электролита применяют расплав солей, окислителями служат FeS или FeS2. По своим характеристикам эти А. близки к серно-натриевым.
Если требуется более высокое напряжение, чем у отдельного А., применяют аккумуляторные батареи, состоящие из последовательно включенных А., имеющих общий корпус, выводы и маркировку. Батареи широко применяют в транспортных средствах для запуска двигателей, освещения и др. Тяговые батареи используют для силовых установок электрокаров, стационарные большой емкости-для электропитания телефонных сетей, в качестве аварийных источников электроэнергии на случай перебоев в электросети (напр., в операционных). Малогабаритные герметичные батареи применяют для питания переносных радиоприемников и др. устройств. Большое внимание уделяется разработке батарей для электромобилей. Мировое производство одних лишь стартерных батарей из свинцовых А. превышает 100 млн. штук в год.
В отличие от гальванич. элементов А. требуют ухода при эксплуатации: их необходимо заряжать, периодически доливать электролит и поддерживать постоянной его концентрацию, проводить тренировочные и контрольные зарядно-разрядные циклы и т. п. Разрабатывают т. наз. малообслуживаемые и необслуживаемые А., уход за которыми упрощен.
Лит.: Романов В. В., Хашев Ю. М., Химические источники тока, 2 изд., М., 1978; Багоцкий В.С., Скундин А. М., Химические источники тока, М., 1981.
В. С. Багоцкий
Значения в других словарях
- Аккумуляторы — Так называются в машиностроительном деле приборы для накопления механической энергии. Изобретены они Армстронгом и основаны на постепенном поднятии на высоту большого груза или на сильном сжатии воздуха. Энциклопедический словарь Брокгауза и Ефрона
