азотная кислота
АЗОТНАЯ КИСЛОТА HNO3
мол. м. 63,016, бесцветная жидкость (см. табл.). Сильная одноосновная кислота (pKа —1,64). Молекула имеет плоскую структуру (длины связей в нм):
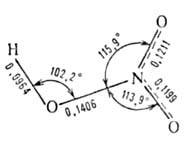
Твердая А. к. образует две кристаллич. модификации — с моноклинной и ромбич. решетками. Конц. кислота малоустойчива, при нагр. или под действием света частично разлагается: 4HNO3 → 4NO2 + 2H2O + O2; образующийся NO2 окрашивает кислоту в бурый цвет и придает ей специфич. запах.
СВОЙСТВА АЗОТНОЙ КИСЛОТЫ И ЕЁ КРИСТАЛЛОГИДРАТОВ

* Температура кипения. ** Для газа при 298 К.
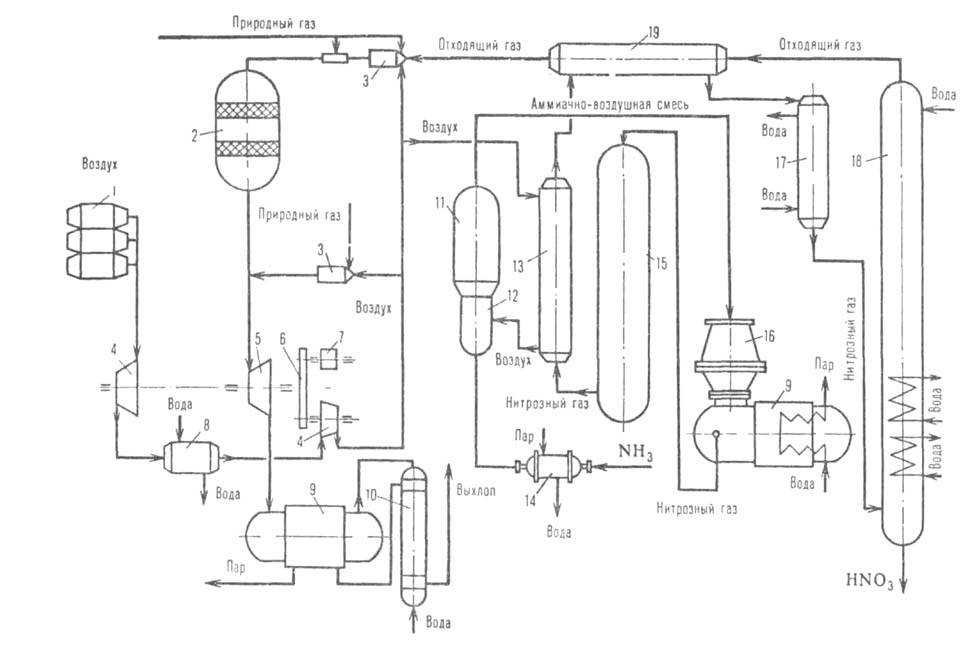
Рис. 1. Схема производства азотной кислоты под единым давлением (0,65–0,70 МПа): 1 — воздушный фильтр; 2 — реактор каталитич. очистки отходящего газа; 3 — камера сгорания; 4 — воздушный компрессор; 5 — газовая турбина; 6 — редуктор; 7 — электродвигатель; 8 — промежут. холодильник; 9 — котел-утилизатор; 10 — экономайзер; 11 — поролитовый фильтр; 12 — смеситель NH3 и воздуха; 13 — подогреватель воздуха; 14 — испаритель NH3; 15 — аппарат для окисления NO; 16 — контактный аппарат для окисления NH3; 17 — холодильник-конденсатор; 18 — абсорбц. колонна; 19 — подогреватель отходящего газа.
А. к. смешивается с водой во всех соотношениях. В водных растворах практически полностью диссоциирует на H+ и NO−3. Образует с водой азеотропную смесь (68,4% по массе HNO3; т. кип. 120,7 °C, d2041,41), моно- и тригидраты. Для водных растворов d204составляет 1,0543 (10%-ная кислота), 1,1150 (20%-ная), 1,3100 (50%-ная), 1,4134 (70%-ная), 1,4826 (90%-ная). Для 49,94%-ного раствора парциальное давление HNO3 и воды составляет (в Па) соотв. 47,91 и 1030,75, для 69,7%-ного-383,04 и 388,36, для 96,48%-ного-5531,47 и 14,63. А. к. ограниченно раств. в эфире.
А. к. — сильный окислитель. Под действием А. к. металлы (за исключением Pt, Rh, Ir, Nb, Zr, Ta, An) превращаются в нитраты или оксиды, сера энергично окисляется в H2SO4, фосфор — в P2O5, орг. соед. окисляются и нитруются. Стойкость конструкц. материалов к А.к. определяется свойствами поверхностных оксидных пленок. В разб. А. к. стойки хромо-никелевые стали, Ti, в концентрированной-чистый А1, высококремнистый чугун, хромо-никель-кремниевые стали. Титан в среде конц. А. к., содержащей растворенные оксиды азота, приобретает пирофорные свойства. В А. к. любой концентрации стойки стекло, кварц, фторопласт-4.
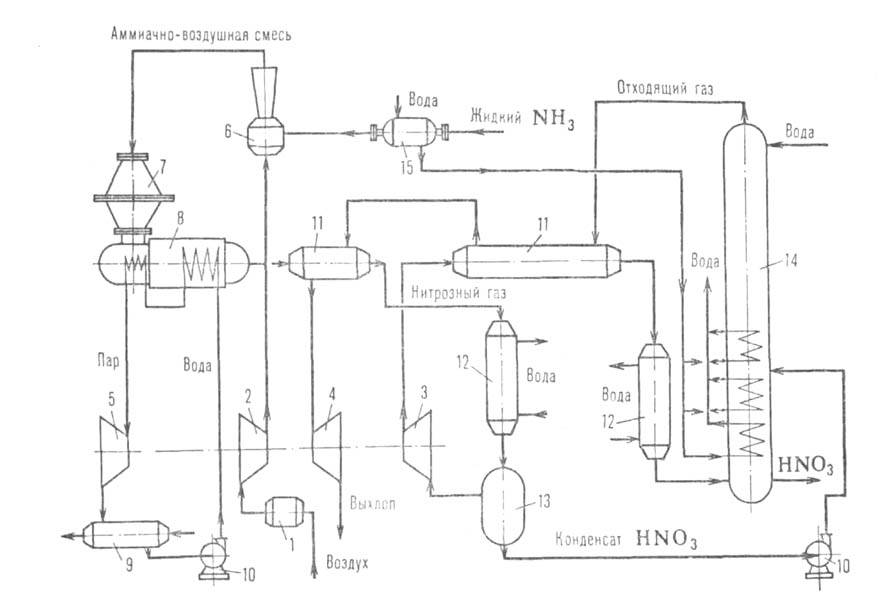
Рис. 2. Схема производства азотной кислоты с двумя ступенями давления (окисление NH3 при 0,35 МПа, абсорбция MO2 при 0,8 МПа): 1 — фильтр воздуха; 2 — воздушный компрессор; 3 — компрессор нитрозного газа; 4 — газовая турбина; 5 — паровая турбина; 6 — смеситель NH3 и воздуха; 7 — контактный аппарат для окисления NH3; 8 — котел-утилизатор; 9 — конденсатор; 10 — насос; 11 — подогреватель отходящего газа; 12 — холодильник-конденсатор; 13 — сепаратор; 14 — абсорбц. колонна; 15 — испаритель NH3.
Для практич. целей используют 30–60%-ные водные растворы А. к. или 97–99%-ные (конц. А. к.). Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) наз. царской водкой; она растворяет даже благородные металлы. Смесь HNO3 концентрации ок. 100% и H2SO4 концентрации ок. 96% при их соотношении по объему ок. 9:1 наз. меланжем.
Пром. методы получения разб. HNO3 включают след. стадии: получение NO, окисление его до NO2, абсорбцию NO2 водой, очистку отходящих газов (содержащих в осн. N2) от оксидов азота. Осн. способ получения NO заключается в окислении NH3 кислородом воздуха в присутствии катализатора: 4МH3 + 5O2 → 4NO + 6H2O + 907,3 кДж. Катализатор-сетка из сплавов Pt (80–95%) с металлами платиновой группы. В СССР используется двухступенчатый катализатор (первая ступень-платиновые сетки, вторая-оксидный неплатиновый катализатор), позволяющий сократить количество загружаемой платины на 40–60%. Потери Pt при одноступенчатом катализаторе, в осн. из-за мех. уноса, составляют (г Pt на 1 т HNO3): 0,05 при 0,1 МПа, 0,1 при 0,4 МПа, 0,15 при 0,7 МПа. При использовании двухступенчатого катализатора потери Pt снижаются на 15–25%.
Окисление NO (2NO + O2 → 2NO2 + 124 кДж) протекает в газовой фазе при охлаждении нитрозного газа (полученного на стадии окисления NH3) до 160–250 °C; ниже 100 °C идет димеризация (2NO2 → N2O4 + 56,9 кДж/моль). Абсорбцию NO2 водой (3NO2 + H2O → 2HNO3 + NO + 136,2 кДж/моль) осуществляют в тарельчатых колоннах со значит. межтарелочными объемами. Отходящий газ содержит 0,02–0,15% по объему оксидов азота, 2–5% O2 и N2; при содержании остаточных оксидов азота более 0,02% проводят их каталитич. восстановление до N2. В случае восстановления аммиаком (кат. — оксиды А1 и V; 250-300СС) происходят реакции:
3NO + 2NH3 → 2,5N2 + ЗH2O 3NO2 + 4NH3 → 3,5N2 + 6H2O
Отходящий газ очищают также на алюмопалладиевом кат. (температура начала реакции 350–500 °C) с использованием в качестве восстановителя прир. газа:
CH4 + 2O2 → CO2 + 2H2O + 802 кДж CH4 + 2NO2 → N2 + 2H2O + CO2 + 868 кДж CH4 + 4NO → 2N2 + 2H20 + CO2 + 1160кДж
Установки по производству разб. HNO3 (см. рис. 1 и 2) характеризуются высокой производительностью (350–1400 т/сут), полнотой использования теплоты хим. реакций, экономным расходованием сырья и вспомогат. материалов.
Конц. А. к. получают двумя осн. способами. Первый заключается в ректификации тройных смесей, содержащих HNO3, воду и к.-л. водоотнимающее вещество, обычно H2SO4 или Mg(NO3)2. В результате получают пары 100%-ной HNO3, которые конденсируют, и водные растворы водоотнимающего агента. Последние упаривают и возвращают в производство. Второй способ основан на реакции: 2N2O4M + 2H2O(ж) + O2(г) → 4HNO3(ж) + 78,8 кДж ("ж"-жидкость, "г"-газ). При давлении ок. 5 МПа и использовании чистого O2 образуется 97–98%-ная HNO3, содержащая до 30% по массе растворенных оксидов азота. А. к. получают разгонкой этого раствора. При 0,7–1,0 МПа и использовании воздуха образуется 80–85%-ная HNO3 и азеотропная смесь А. к. с водой. Жидкий N2O4 получают гл. обр. путем растворения NO2, содержащегося в нитрозном газе, 80–100%-ной HNO3 с послед. разгонкой этого раствора и конденсацией жидкого N2O4.
А. к. особой чистоты производят ректификацией 97–98,5%-ной HNO3 в аппаратуре из силикатного или кварцевого стекла. Содержание примесей в такой кислоте менее 1∙10−6% по массе.
Метод получения А.к., основанный на взаимод. N2 и O2 воздуха выше 2200 °C (N2 + O2 → 2NO + 180,6 кДж) с послед. быстрым охлаждением NO, его окислением и абсорбцией NO2 водой, распространения пока не получил.
Осн. количество разб. HNO3 расходуется в производстве NH4NO3 и сложных минер. удобрений, нитратов Na, К, Ca и др., в гидрометаллургии. Конц. кислота используется при получении ВВ, H2SO4, H3PO4, ароматич. нитросоединений, красителей, входит в состав ракетного топлива. А. к. используется также для травления металлов, полупроводниковых материалов и др.
Производство А. к. взрывоопасно из-за использования в нем горючих и взрывоопасных веществ — NH3 и прир. газа. Под действием А. к. воспламеняются бумага, масло, древесина, уголь. При попадании на кожу она вызывает ожоги. Аммиак, пары HNO3, оксиды азота токсичны. ПДК паров HNO3 и оксидов азота 2 мг/м3 (в пересчете на NO2). Производство А.к. в развитых кап. странах ок. 22 млн. т (1982).
Лит.: Справочник азотчика, под ред. Н. А. Симулина [и др.], т. 2, М., 1969; А трощен ко В. И., Каргин С. И., Технология азотной кислоты, М., 1970; Производство азотной кислоты в агрегатах большой единичной мощности, под ред. В. М. Олевского, М., 1985.
А. А. Солоха
Значения в других словарях
- Азотная кислота — HNO3, одноосновная сильная кислота, при обычных условиях бесцветная жидкость; один из наиболее важных продуктов химической промышленности. Структурная формула: Физические и химические свойства. Плотность безводной А. Большая советская энциклопедия
- АЗОТНАЯ КИСЛОТА — АЗОТНАЯ КИСЛОТА (HNO3), бесцветная жидкость, одна из самых сильных минеральных кислот. Испаряется на воздухе, приобретая желтую окраску в результате разложения на ДВУОКИСЬ АЗОТА (NО2). Научно-технический словарь
- АЗОТНАЯ КИСЛОТА — АЗОТНАЯ КИСЛОТА — HNO3, бесцветная жидкость с резким удушливым запахом; плотность 1,513 г/см3, tпл -41,59 °C, tкип 82,6 °C. С водой смешивается во всех отношениях. В промышленности получают каталитическим окислением аммиака. Большой энциклопедический словарь
- Азотная кислота — I (acidum nitricum, acide azotique) — крепкая водка, или селитряная кислота HNO3 или NO2ОН — одна из важнейших минеральных кислот. Энциклопедический словарь Брокгауза и Ефрона
