азотистая кислота
АЗОТИСТАЯ КИСЛОТА HNO2
бесцветное вещество, существующее в виде паров или водного раствора. Нагревание паров или их конденсация, а также концентрирование водных растворов приводят к разложению А. к.: в парах-по реакции 2HNO2 ⇄ NO + NO2 + H2O, в p-pe-3HNO2 ⇄
⇄ HNO3 + 2NO + H2O. Сильные неорг. кислоты катализируют разложение. А.к. существует в двух таутомерных формах:
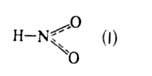
и НО—N=O (II), для каждой из которых известны свои ряды комплексных соед. и орг. производных, содержащих соотв. нитрогруппу NO2 и нитритогруппу ONO. При 298 К равновесная смесь содержит 0,309 мольных долей I и 0,691 мольных долей П. Для газообразных I и II C0p соотв. 45,4 и 46,0 Дж/(моль∙К); Δ H°обр −77,4 и −79,5 кДж/моль, ΔG°обр −42,6 и −44,6кДж/моль; S0298 249 Дж/(моль∙К).
А. к. — одноосновная кислота средней силы; при 12,5 °C pKа 3,37, степень диссоциации в 0,1 н. водном растворе 6,5%. С основаниями образует соли-нитриты. Сильными окислителями (H2O2, KMnO4 и др.) окисляется до HNO3. Восстанавливается до NO (под действием HI и др.), H2N2O2 (под действием NH2OH) или до смеси NO + N2O + H2N202.
Получают А.к. действием неорг. кислот на нитриты; .применяют в орг. синтезе для получения солей диазония и др. cоединений.
Э. Г. Раков
Значения в других словарях
- Азотистая кислота — HNO2, одноосновная, нестойкая, довольно слабая кислота, существующая только в разбавленных холодных водных растворах. Структурная формула HO—N = О. Константа диссоциации А. к. 4,5․10-4 при 18°C. Большая советская энциклопедия
- Азотистая кислота — Ангидрид N2О3, гидрат NOOH. Получается одновременно с азотноватым ангидридом при нагревании азотной кислоты с мышьяковистой кислотой в виде бурого, вызывающего сильный кашель газа, сгущающегося на сильном холоде в синюю жидкость, закипающую при +2°. Энциклопедический словарь Брокгауза и Ефрона
