Эльбса реакции
ЭЛЬБСА РЕАКЦИИ
1) получение двухатомных фенолов действием персульфатов на одноатомные фенолы в щелочной среде (окисление по Эльбсу, персульфатное окисление), напр.:
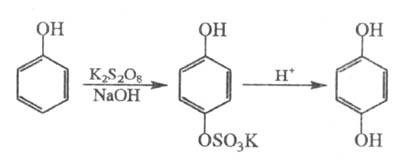
Электронодонорные заместители ускоряют, а электроноакцепторные замедляют реакцию. Вторая группа НО обычно вступает в пара-положение (если оно занято, то образуются opmo-дифенолы, но выход резко снижается). Гладко в Э. р. вступают крезолы, n-галоген-, о- и n-нитрофенолы, м-гидроксибензальдегид и м-гидроксибензойная кислота. Окисление двухатомных фенолов часто сопровождается разрушением ароматич. ядра. Если одну из групп НО предварительно проалкилировать, то реакция протекает обычным образом.
α -Нафтол и его производные дают с хорошими выходами 1,4-дигидроксипроизводные, β-нафтол и 2-гидрокси-3-нафтойная кислота образуют 1,2-дигидроксипроизводные, но с низкими выходами.
Реакцию обычно осуществляют добавлением на холоде насыщ. водного раствора K2S2O8 или (NH4)2S2O8 к щелочному раствору фенола с послед. подкислением. Использование смеси K2S2O8 и ацетата Pd позволяет вести прямое ацетоксилирование одноатомных фенолов. Выходы, как правило, не превышают 50%.
Осн. побочные продукты — изомерные дигидроксифенолы (характерны для реакции замещенных фенолов), хиноны и продукты их дальнейшей деструкции.
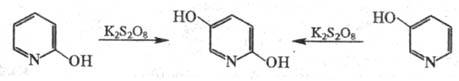
В реакцию, подобную Э. р., также вступают гидроксипроизводные флавона, кумарина, некоторых азотсодержащих гетероциклов, напр.:
Механизм реакции окончательно не выяснен. Предполагают, что она может осуществляться по свободнорадикальному механизму (следы Fe2+ в персульфате катализируют образование анион-радикала SO−4, который атакует пара-положение фенолят-иона) или ионному (атака феноксид-аниона ионом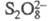 и послед. перегруппировка образовавшегося аддукта).
и послед. перегруппировка образовавшегося аддукта).
Э. р. используют в препаративной практике; открыта К. Эльбсом в 1893.
Лит.: Sethna S., "Chem. Revs.", 1951, № 49, № 1, p. 91–101; Sheldon R., Koschi J., Metall-catalized oxidation of organic compounds, N. Y., 1981; Capdevielle P., Maumy M., "Tetrahedron letters", 1982, v. 23, № 15, p. 1573–76, 1577–80.
2) Термич. циклодегвдратация диарилкетонов, содержащих в орто-положении группы CH3 или CH2, с образованием конденсир. аромстич. углеводородов, напр.:
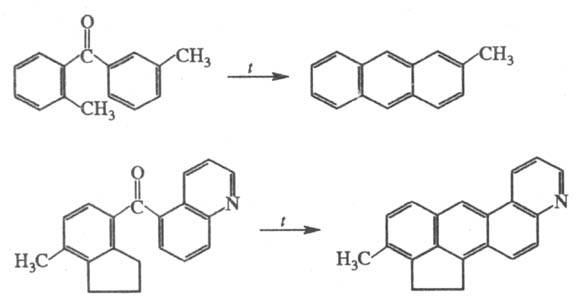
Реакцию обычно осуществляют при 350–500 °C в течение неск. часов или суток до прекращения выделения H2O. Выходы обычно не превышают 50%.
Осн. побочные процессы: миграция карбонильной группы и др. внутримол. перегруппировки; отщепление заместителей (Alk, AlkO, Hal) из ароматич. ядра; гидро- и дегидрогенизация.
Механизм реакции не выяснен. Полагают, что первоначально кетон переходит в енольную форму с образованием сопряженной системы связей; затем следует внутримол. присоединение др. ароматич. кольца с образованием производного дигидроантранола, который подвергается дегидратации. Существуют и др. представления о механизме этой реакции.
Реакцию циклодегидратации используют в препаративной практике как наиб. экономичный и быстрый способ синтеза некоторых производных дибензо[а,h]антрацена, холантрена и динафтохризенов.
Реакция открыта К. Эльбсом в 1884.
Лит.: Физер Л., в сб.: Органические реакции, пер. с англ., сб. 1, М., 1948, с. 163; Фьюзон Р., Реакции органических соединений, пер. с англ., М., 1966, с. 450–51.
Г. И. Дрозд
