Тиле — Винтера реакция
ТИЛЕ — ВИНТЕРА РЕАКЦИЯ
ацетоксилирование и одновременное ацетилирование хинонов, сопровождающееся ароматизацией, при действии уксусного ангидрида в присутствии кислых катализаторов, напр.:
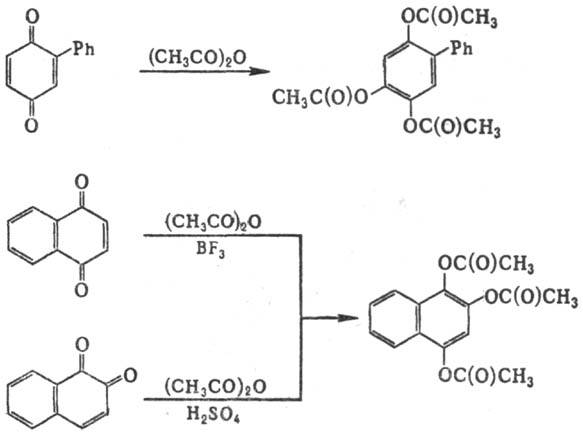
Наиб. активные катализаторы-минер. кислоты (обычно H2SO4, HCl или HClO4), менее активен BF3 (в смеси с эфиром или CH3COOH). Так, 2,6-диметил-1,4-бензохинон вступает в Т.-В. р. в присутствии H2SO4, но не реагирует в присутствии эфирата BF3.
Монозамещенные 1,4-бензохиноны [заместители: Alk, Ar, Hal, OCH3, C(O)CH3] и 3-замещенные нафтохиноны сравнительно легко вступают в реакцию. Бензохиноны, замещенные в положении 2, ацетоксилируются в положение 5; введение заместителя в положение 2 нафтохинонов препятствует протеканию реакции.
1,4-Бензохиноны с электроотрицат. заместителями в положениях 2,5 и 2,6 (напр., CH3O или Cl), а также многие 2,3,5-замещенные бензохиноны (напр., 2-бром-3-метокси-5-метил- и 2,3,5-триметилбензохиноны) в Т.-В. р. не вступают.
Реакцию обычно проводят при 20–50 °C в среде уксусного ангидрида, к которому добавляют сначала хинон, затем катализатор; смесь выдерживают при указанной температуре от неск. часов до неск. суток. Выходы колеблются в пределах от 40–55 до 80%.
Считают, что Т. — В. р. начинается с протежирования карбонильной группы хинона с образованием карбкатиона (формула I); последний присоединяет ацетат-ион с образованием промежут. оксосоединения (II), претерпевающего ароматизацию. Образовавшееся производное гидрохинона (III) подвергается далее ацетилированию (не исключено, что ацетилированию подвергается группа OH промежут. соед. I или II):
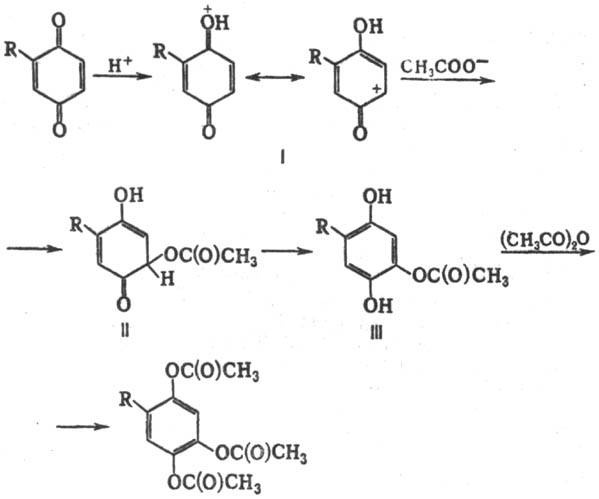
Т.-В. р. используют в препаративном синтезе для введения кислородсодержащих функций в ароматич. ядро, что применяют, напр., для облегчения выделения некоторых прир. соединений.
Р.-ция открыта в 1900 И. Тиле и Э. Винтером.
Лит.: McOmie J. F. W., Blatchly J. М., в кн.: Organic reactions, v. 19, N. Y., 1972, р. 199–277.
Г. И. Дрозд
