Симмонса — Смита реакция
СИММОНСА — СМИТА РЕАКЦИЯ
превращение алкенов в циклопропаны под действием метилиодида и пары Zn-Cu. Предполагают, что активная частица в этой реакции-иодид иодметилцинка (формула I; реагент Симмон-са-Смита), который и переносит метиленовую группу на двойную связь, предположительно, путем первоначального присоединения реагента и послед, отщепления ZnI2: CH2I2 + Zn → ICH2ZnI
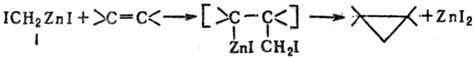
Пару Zn-Cu обычно получают нагреванием Zn-пыли с CuCl в эфире в атмосфере N2. В эфире осуществляют и основную реакцию.
Присоединение метилена к двойной связи обычно происходит стереоспецифично; из транс-алкенов образуются транс-циклопропаны, а из цис-алкенов — цис-циклопропаны.
В реакцию вступают алкены, содержащие функц. группы,: причем выходы циклопропанов выше в случае алкенов с электронодонорными группами. n-Метоксистирол дает соответствующий циклопропан с выходом 70%, стирол — 32%, винилацетат-31%, метиловый эфир кротоновой кислоты-9%.
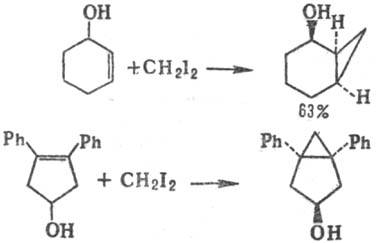
Присутствие в кольце ненасыщ. алицикла гидроксигруппы оказывает ориентирующий эффект, а также приводит к существенному ускорению реакции и увеличению выходов, напр.:
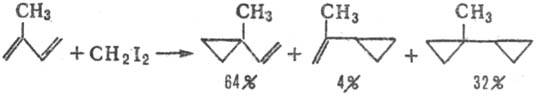
В случае диенов образуется смесь продуктов, причем присоединение преим. идет по двойной связи, рядом с которой имеется большее число алкильных групп:
Вместо меди м. б. использованы галогениды меди (напр., CuCl) или серебро. Использование пары Zn-Ag обычно приводит к более высоким выходам.
Реакция открыта Х. Симмонсом и Р. Смитом в 1958.
Лит.: Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ., т. 3, М., 1970, с. 286–90; Марч Дж., Органическая химия, пер. с англ., т. 3, М., 1987, с. 269–70; Simmons H. E. [а. о.], в кн.: Organic reactions, v. 20, N.Y.-L., 1973.
В. В. Жданкин
