Реппе реакции
РЕППЕ РЕАКЦИИ
1) Синтез карбоновых кислот и их производных взаимод. CO с разл. орг. соединениями (в т. ч. с ненасыщ. углеводородами) и соединениями с подвижным атомом Н, напр.:
RC=CH + CO + НХ : RCH=CHC(O)X 2RCH=CH2 + 2CO + 2НХ : RCH2CH2C(O)X + CH3CHRC(O)X
ROH + CO + HX → RC(O)X + H2O ROR' + CO + HX → RC(O)X + ROH X = HO,R:O,HS,R:S,R:COO,NHR:
P.p. относится к реакциям карбонилирования. Ее осущест-вляют в присутствии карбонилов металлов (обычно карбонилы Со или Ni), которые служат катализаторами, а при их избытке- и источниками СО. В зависимости от соотношении количества используемых в реакции карбонилов металлов и реагентов различают два осн. способа ее проведения-"стехио-метрический" и "каталитический". В первом способе карбонилы металлов и др. реагенты берутся в стехиометрия, количествах; реакция проходит при относительно низких давлениях и температурах: 5–10 МПа, 50–60 °C (ацетилены) и 160–170 °C (олефины). Во втором способе карбонилы металлов берутся в небольших (каталитич.) количествах; реакцию осуществляют с использованием стехиометрич. количеств CO при давлении ок. 20 МПа и температурах 150–180 °C (для ацетиленов) и 180–200 °C (для олефинов).
Карбонилирование ацетилена приводит к акриловой кислоте. Монозамещенные ацетилены обычно образуют один продукт, дизамещенные-два возможных изомера:
CH3C=CH + CO + H2O → CH2=С(CH3)СООН 2РhC=CCH3 + 2CO + 2H2O → PhCH=C(CH3)COOH + CH3CH=C(Ph)COOH
2RCH=CHR' + 2CO + 2H2O → RCH2CHR'COOH + R'CH2CHRCOOH
При карбонилировании гем-дизамещенных этилена доля триалкилуксусной кислоты не превышает, как правило, 15%:
RR'C=CH2 + CO + H2O → RR'CHCH2COOH + CH3CRR'COOH
Селективность карбонилирования сопряженных диенов значительно зависит от условий реакции. Так, в реакции 1,4-бута-диена в присутствии пиридина и Co2(CO)8 при 160–200 °C и 25 МПа образуется в осн. 4-пентеновая кислота:
CH2=CHCH=CH2 + CO + H2O → CH2=CHCH2CH2COOH
При 210 °C и 43 МПа в этой же реакции образуется смесь адипиновой HOOC(CH2)4COOH, α-метилглутаровой HOOCCH(CH3)CH2CH2COOH, этилянтарной HOOCCH(C2H5)CH2COOH и валериановой CH3(CH2)3COOH кислот.
При синтезе кислот и сложных эфиров из олефинов и диенов высокую каталитич. активность проявляют комплексы Pd2+. В условиях гомог. или гетерог. катализа они позволяют смягчить условия проведения реакции и повысить селективность процесса.
Карбонилирование метанола до уксусной кислоты с использованием карбонилов Со или Ni происходит в очень жестких условиях [в присут. Co2(CO)8 при 230 °C и 60 МПа]. В более мягких условиях (175 °C, 3–4 МПа) реакция осуществляется В присут. кат. Паулика-Рота (карбонилиодидный комплекс Rh), который используют для промышленного производства уксусной кислоты.
Многоатомные спирты карбонилируются с образованием поликарбоновых кислот, напр.:
НО(CH2)4OH + 2СО : HOOC(CH2)4COOH
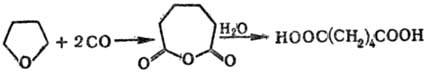
Фенолы в P.p. не вступают. Карбонилированием тетра-гидрофурана получают адипиновую кислоту:
2) Синтез простых и сложных виниловых эфиров, винил-сульфидов и виниламинов взаимод. ацетилена со спиртами, фенолами, кислотами, меркаптанами и аминами в присутствии основных катализаторов (щелочных и щел.-зем. гидрокси-дов и алкоксидов, NaH, KCN и др.):
CH=CH + НХ : ХCH=CH2 X = OR, OAr, RCOO, SR, NHR
Реакцию осуществляют при 150–200 °C и давлении до 4 МПа. Фенолы более реакционноспособны, чем спирты; β- и γ-непредельные спирты, как правило, не винилируются.
Третичные амины в условиях Р. р. реагируют по схеме:
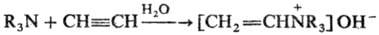
Механизм реакции включает стадию образования карбаниона (В-основание):
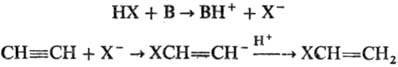
В условиях P.p., используя в качестве катализаторов Zn-или Cd-соли карбоновых кислот, можно осуществить виншгирование β-дикарбонильных соед. (ацетилацетона, малонового и ацетоуксусного эфиров и др.) и сложных эфиров. В присут. таких катализаторов фенолы подвергаются С-винилированию.
3) Конденсация ацетилена и его монозамещенных гомологов с альдегидами или кетонами (алкинольный синтез), аминами (аминобутиновый синтез) или α-гидроксиаминами (аминопропиновый синтез) в присутствии ацетиленидов Cu, Hg, Ag или Au. Реакции осуществляют обычно при повышенной температуре и давлении до 2 МПа.
Алкинольный синтез:
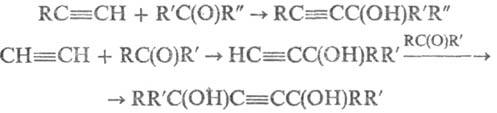
В случае альдегидов (R' = Н) присоединение второй молекулы затрудняется с ростом длины углеводородной цепи. Аминобутиновый синтез:
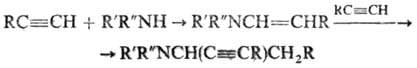
Аминопропиновый синтез:
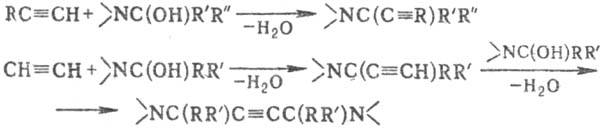
Вместо гидроксиаминов в реакцию можно вводить амин (триалкиламин, пиперидин, морфолин и др,) и альдегид (обычно CH2O).
4) Циклоолигомеризация ацетилена и его гомологов с образованием бензола, циклооктатетраена и их производных, а также циклополиолефинов более высокой мол. массы, напр.:
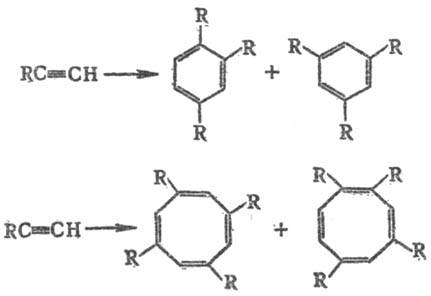
Реакцию осуществляют при 60–120 °C и 1,5–2,5 МПа в органическом растворителе (бензоле, циклогексане, ТГФ, диоксане, ДМФА и др.), кат. — Ni(CN)2, Ni(SCN)2, никелевые производные β-дикарбонильных соед., комплексы типа Ni(CO3)3(MR3) и Ni(CO)2(MR3)2, где М = P, As и Sb, R = Alk, Ar. Высокую активность при циклотримеризации проявляют монозаме-щенные алкины с R = Alk, Ar, CH=CH2, OR', NR'2, C(O)R', OH и COOR', мало активны алкины с R = COOH, CN, C(O)NH2. Селективность циклотримеризации зависит от природы катализатора. Циклотримеризацию дизамещенных алкинов можно осуществить в присутствии Fe(CO)2, Co2(CO)8 и Hg[Co(CO4)]2. Циклооктатетраен с большим выходом образуется при проведении реакции в ТГФ в присутствии Ni(CN)2. P.p. лежат в основе мн. пром. процессов, в т. ч. крупнотоннажных, позволяющих получать разнообразные хим. вещества. Они разработаны В. Реппе в 1930–50.
Лит.: Houben-Weyl, Methoden der Organischen Chemie, B3 4, Tl 2, Stuttg., 1955, S. 407, 413; там же, Bd 6, Tl 2, S. 664. См. также лит. при ст. карбонилирование.
А. А. Соловьянов
Значения в других словарях
- Реппе реакции — Синтезы на основе окиси углерода и ацетилена, разработанные немецким химиком В. Реппе (W. Reppe) в Германии в период 2-й мировой войны 1939—45; важнейшие из них приведены ниже. Большая советская энциклопедия
