Рамберга — Бэклунда реакция
РАМБЕРГА — БЭКЛУНДА РЕАКЦИЯ (Рамберга — Бэклунда перегруппировка)
синтез олефинов действием сильных оснований (В−) на α-галогенсульфоны, содержащие хотя бы один атом Н в α-положении к группе SO2:
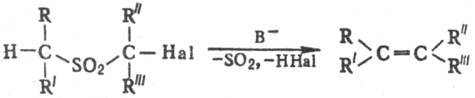
Реакцию обычно осуществляют нагреванием галогенсульфона с большим избытком основания: с водными или воднодиок-сановыми растворами щелочей при 50–100 °C; с CH3ONa в CH3OH при кипячении; с (CH3)3СОК в (CH3)3СОН или ТГФ при 0–65 °C. В продуктах реакции преобладают цис-изомеры, за исключением тех случаев, когда в качестве основания используют (CH3)3СОК. Скорость реакции в зависимости от природы галогена в а-положении увеличивается в ряду: С1 < Br < L
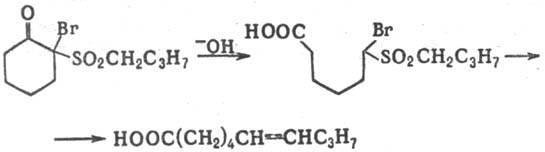
Циклич. α-галоген-α-сульфонилкетоны раскрывают цикл с образованием непредельных кислот, напр.:
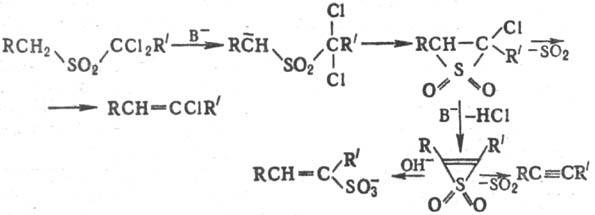
α, α- и α,α'-Дигалогенсульфоны в условиях Р.-Б.р. образуют три типа продуктов (ацетилены, винилхлориды и α,β-ненасыщенные сульфокислоты):
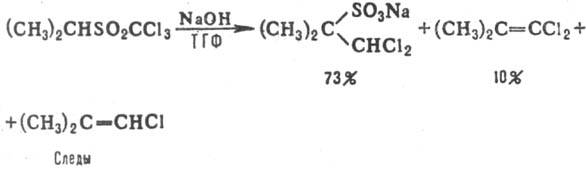
При использовании в реакции α,α,α-трихлорметилсульфонов преобладают дихлорпроизводные сульфокислот, напр.:
Общепринятый механизм реакции включает стадии образования а-карбаниона (формула I), элиминирование галогенид-аниона с образованием тииран-1,1-диоксида (лимитирующая стадия), а затем SO2:
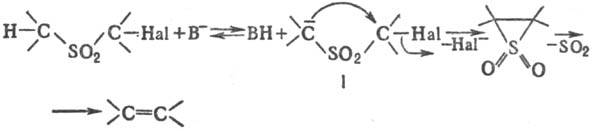
Последняя стадия протекает в осн. стереоспецифично как цис-элиминирование и м. б. описана как разрешенная по симметрии нелинейная хелетропная реакция.
Наиб. важная модификация Р. — Б. р. — взаимод. сульфонов с CCl4 и KOH в (CH3)3СОН. При этом сульфон легко хлорируется и образующийся α-хлорсульфон реагирует по приведенной выше схеме.
Р.-Б.р. широко применяют в лаб. практике. Она открыта в 1940 Л. Рамбергом и Б. Бэклундом.
Лит.: Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 240–43; Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 67–69; Bord-well F. G., "Ace. Chem. Res.", 1970, v. 3, № 9, p. 281–90; Schneller S., "Int. J. Sulfur Chem.", 1973, v. 8, № 3, p. 485–503; Magnus Ph. D., "Tetrahedron", 1977, v. 33, № 16, p. 2019–45; Paquette L, "Organic Reactions", v. 25, N. Y., 1977, p. 1–71.
Ф. М. Стоянович
