Коупа перегруппировка
КОУПА ПЕРЕГРУППИРОВКА
изомеризация 1,5-ненасыщенных орг. соед., сопровождающаяся миграцией аллильной группы с одноврем. сдвигом двойной связи, напр.:
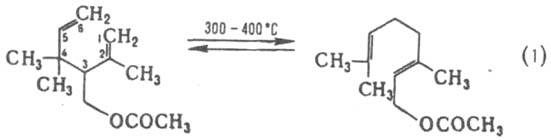
К. п. проводят: при нагр. в вакууме или инертной атмосфере при 150–450 °C; в присутствии комплексов Pd(II) или Ni(0) при 0–20 °C; под действием КН в ТГФ в присутствии краун-эфиров при 0–65 °C; при термолизе под давлением св. 100 МПа. Наиб. изучены обратимая изомеризация 1,5-диолефинов (реакция 1) и необратимое превращ. 1,5-енин-3-олов (реакция 2) в ненасыщ. карбонильные соед. (т. наз. гидроокси-перегруппировка Коупа):
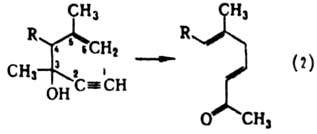
Эти реакции обычно ускоряются в присутствии электроно-акцепторных групп в положениях 3 и 4 и, в меньшей степени, электронодонорных групп в положениях 2 или 5; заместители в положениях 1 или 6 замедляют реакцию. Наиб. распространено представление о протекании К. п. по согласованному механизму, включающему [3,3] — сигматропный сдвиг, который осуществляется через "креслоподобное" б π-электронное переходное состояние (формула I):
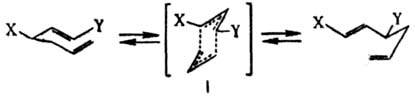
Считают также, что реакция может протекать по гомолитич. механизму через промежут. образование пары аллильных радикалов или циклогексан-1,4-диильного бирадикала. Побочный процесс при изомеризации 1,5-енин-3-олов-распад исходного соед. на низший олефин и α,β-ненасыщенное карбонильное соединение. К. п. используют в орг. синтезе, напр. при получении гераниола, псевдоионона, терпеноидов, алкалоидов и др. К. п. открыта А. Коупом и Э. Харди в 1940.
Лит.: Вудворд Р., Хоффман Р., Сохранение орбитальной симметрии, пер. с англ.. М.. 1971, с. 126–32, 160–63; Темникова Т. И., Семенова С. Н., Молекулярные перегруппировки в органической химия. Л., 1983; Rhoads S.J., Raulins N. R., в кн.: Organic reactions, v. 22, N.Y.-U 1975, p. 1–252; Lutz R. P., "Chem. Rev.", 1984, v. 84, № 3. p. 205–47; Overman LE, "Angew. Chem.", 1984, Bd 96, № 8, S. 565–73.
Э. П. Серебряков
