Арндта — Айстерта реакция
АРНДТА — АЙСТЕРТА РЕАКЦИЯ
превращ. карбоновой кислоты в след. высший гомолог или его производное. Реализуется через три последовательные стадии: получение галогенангидрида кислоты, получение диазокетона, перегруппировка диазокетона в кислоту или ее производное (Вольфа перегруппировка):
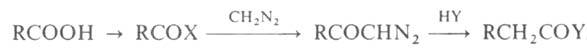 "
"
где Х-обычно С1, реже Br; Y = OH, OR', NR'R". A. — A.p.
применима к алифатич., алициклич., ароматич. и гетероциклич. карбоновым кислотам. Использование на второй стадии др. алифатич. диазосоединений вместо CH2N2 приводит к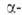 замещенным кислотам или их производным.
замещенным кислотам или их производным.
Диазокетон образуется в результате элиминирования галогеноводорода из образующегося промежуточно диазоний-галогенида (формула I), который может отщеплять N2, образуя побочный продукт — хлорметилкетон (II) (реакция Нирен-штайна):
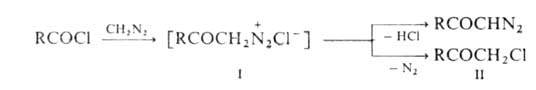
Выделяющийся в реакции галогеноводород связывают избытком CH2N2 или триэтиламином.
А.-А. р. имеет преимущество перед др. методами удлинения цепи карбоновых кислот, поскольку не связана с применением восстановителей. Благодаря этому реакцию можно использовать, напр., для соединений, содержащих нитрогруппу. Суммарный выход по всем трем стадиям А.-А. р. обычно 50–80%. Метод применяют для препаративных целей.
Способ синтеза диазокетонов разработал Ф. Арндт в 1927–28, метод в целом (с использованием перегруппировки Вольфа) — Ф. Арндт и Б. Айстерт в 1935.
Лит.: Кнунянц И. Л. [и др.], "Успехи химии", 1958, т. 27, в. 12, с. 1361–436; Фридман А. Л. [и др.], там же, 1972, т. 41, в. 4, с. 722–57.
Е. М. Рохлин
