Перманганатометрия
Перманганатоме́трия
(от Перманганаты и ...метрия (См. …метрия))
метод химического титриметрического анализа (См. Титриметрический анализ), основанный на применении растворов перманганата калия (См. Перманганат калия) (KMnO4) для количественных объёмных определений (см. Количественный анализ, Объёмный анализ). Преимущество П. заключается в том, что для неё отпадает необходимость в применении специального индикатора при установлении точки эквивалентности, так как раствор KMnO4 имеет характерный фиолетово-красный цвет. В большинстве случаев титрование восстановителей [например, Fe (ll) и Mn (II), Mo (III) и Ti (lll), 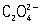 ,
, 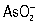 ,
, 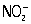 , H2O2] стандартным раствором (См. Стандартный раствор) KMnO4 проводится в кислой среде; окислительно-восстановительная реакция протекает тогда по схеме:
, H2O2] стандартным раствором (См. Стандартный раствор) KMnO4 проводится в кислой среде; окислительно-восстановительная реакция протекает тогда по схеме: 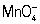 + 8H+ + 5e- ⇔ Mn2+ + 4H2O. Некоторые вещества (например, сульфиты, сульфиды, тиосульфаты, гидразин) окисляются легче в нейтральной или щелочной среде: в этом случае реакция идёт по схеме:
+ 8H+ + 5e- ⇔ Mn2+ + 4H2O. Некоторые вещества (например, сульфиты, сульфиды, тиосульфаты, гидразин) окисляются легче в нейтральной или щелочной среде: в этом случае реакция идёт по схеме:
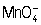
+ 4H+ + 3е- = MnO2 + 2H2O.
Ряд металлов (Ca, Mg, Zn, La, Th) определяют, сочетая метод осаждения (в виде оксалатов) и П.
Лит. см. при ст. Оксидиметрия.
Значения в других словарях
- перманганатометрия — орф. перманганатометрия, -и Орфографический словарь Лопатина
- перманганатометрия — ПЕРМАНГАНАТОМЕТРИЯ титриметрич. метод анализа, основанный на реакциях: + 8H+ + 5е 4H2O + Mn2+ и + 4H2O + Зе ⇄ MnO2 + 4OH− (стандартные электродные потенциалы соотв. +1,52 и +0,57 В). Химическая энциклопедия
- ПЕРМАНГАНАТОМЕТРИЯ — ПЕРМАНГАНАТОМЕТРИЯ — титриметрический метод количественного анализа, основан на окислении исследуемого вещества перманганатом калия. Большой энциклопедический словарь
