Иодометрия
Иодоме́трия
Метод титриметрического анализа (См. Титриметрический анализ) веществ, которые обладают окислительными или восстановительными свойствами, основанный на использовании обратимой реакции: 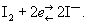 Систему I2/2I—, Нормальный потенциал которой равен + 0,5345 в (25 °С), используют для определения восстановителей с потенциалом меньше + 0,5345 в (например, солей двухвалентного олова, сероводорода) и окислителей с потенциалом больше + 0,5345 в (например, перекисей, хромовой и марганцовой кислот, солей двухвалентной меди и трёхвалентного железа). Рабочими растворами при титровании служат растворы иода и тиосульфата натрия (См. Тиосульфат натрия), индикатором — крахмал.
Систему I2/2I—, Нормальный потенциал которой равен + 0,5345 в (25 °С), используют для определения восстановителей с потенциалом меньше + 0,5345 в (например, солей двухвалентного олова, сероводорода) и окислителей с потенциалом больше + 0,5345 в (например, перекисей, хромовой и марганцовой кислот, солей двухвалентной меди и трёхвалентного железа). Рабочими растворами при титровании служат растворы иода и тиосульфата натрия (См. Тиосульфат натрия), индикатором — крахмал.
Лит.: Крешков А. П., Основы аналитической химии, 3 изд., ч. 2, М., 1971.
Источник:
Большая советская энциклопедия
на Gufo.me
Значения в других словарях
- иодометрия — ИОДОМЕТРИЯ (от иод и греч. metreo — измеряю) титриметрич. метод определения окислителей и восстановителей, основанный на реакции: I3− + 2е ⇄ 3I− (стандартный электродный потенциал + 0,5355 В). Ион I3− образуется при растворении I2 в воде в присутствии KI. Химическая энциклопедия
- ИОДОМЕТРИЯ — ИОДОМЕТРИЯ — титриметрический метод анализа, основанный на окислении исследуемого вещества иодом. Включает методы прямого (раствором I2 в водном растворе KI) и обратного (избыток I2 оттитровывают раствором Na2S2O3) титрования. Большой энциклопедический словарь
