фторирование
ФТОРИРОВАНИЕ
1) Введение атома фтора в молекулу хим. соединений. Ф. орг. соединений осуществляют прямым (заместительным) фторированием либо присоединением F2, HF или др. неорг. фторидов по кратным связям.
Прямое Ф. — сильно экзотермич. процесс, поэтому проведение его требует особых приемов для отвода тепла, чтобы предотвратить деструкцию связей С —С. Один из таких приемов — проведение реакции при низких температурах в условиях сильного разбавления: фтор разбавляют инертными газами, а фторир. соед. — инертными по отношению к фтору орг. растворителями. Кроме F2 используют фториды металлов, напр.:
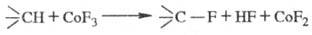
Для синтеза хладонов применяют жидко- и газофазное Ф. хлор- или бромпарафинов фтором в присутствии неорг. фторидов.
В качестве агента Ф. в реакциях обмена галогена на фтор, а также в реакциях окислит. Ф. кратных связей в полигалогенир. алкенах используют SbF3 (реакция С в ар т с а). Иод и бром обмениваются легче, чем хлор. В случае полигалогенпроиз-водных полное перегалогенирование невозможно, т. к. по мере увеличения числа атомов F в молекуле дальнейшее Ф. затруднено из-за стерич. факторов, напр.:
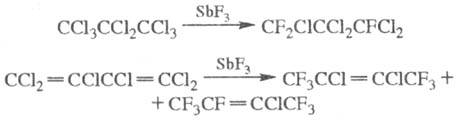
Особенно легко замещается атом Cl, сопряженный с кратной связью, а также Cl в хлорангидридах кислот. Реакция Свартса — пром. способ получения (фторир. соед.
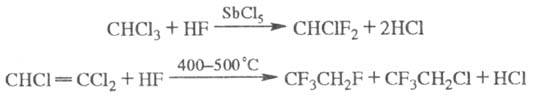
Часто для заместительного Ф. используют газообразный безводный HF в присутствии галогенидов Sb, Sn и др. при 70–150 °C и 0,6–2,5 МПа либо в присутствии катализатора (AlF3, CrF3 и др.) при нагревании, напр.:
Эффективными реагентами для замещения водорода на фтор в ароматич. системах служат гипофториты RFOF (RF — перфторир. орг. радикал):
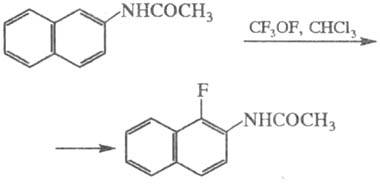
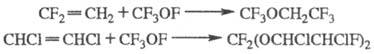
Гипофториты присоединяются также по двойной связи олефинов, образуя фторалкоксипроизводные и фтортеломеры, напр.:
В пром. орг. синтезе широко применяют электрохим. Ф. Процесс осуществляют в электролитич. ванне, содержащей безводный HF, на Ni-аноде при 5–6 В (реакция Саймонса). Метод наиб. удобен для Ф. низкомол. соед. вследствие меньшей деструкции фторир. молекулы, а также для Ф. соед., содержащих функциональные группы (амины, карбоновые кислоты и др.), напр.:
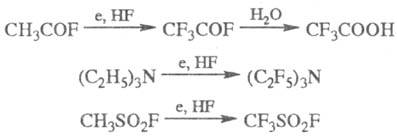
Преимущество электрохим. Ф. — простота аппаратуры и дешевый источник фтора.
Соед., содержащие карбонильную группу, фторируются SF4 в присутствии HF, BF3; реакция происходит через промежут. образование реакционноспособного иона SF+3, напр.:
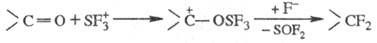
Для Ф. галогенсодержащих орг. соед. применяют галоген-фториды, напр.:
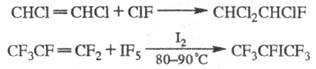
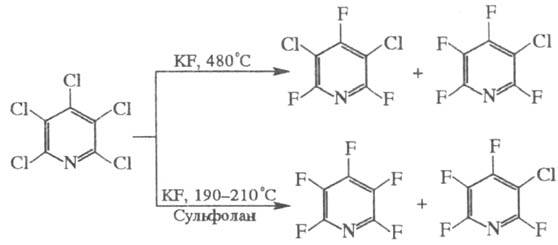
Ф. ароматич. соед. осуществляют чаще всего через диазо-ниевые соли по Шимана реакции. Для получения перфторир. ароматич. соед. можно использовать действие KF в апротон-ном растворителе или без него при повышенной температуре на другие галогенароматич. соединения; этим методом можно получить целую гамму полифторпроизводных, напр.:
Ф. орг. соед. используют для синтеза хладонов, заменителей крови, фторолефинов — мономеров для получения термостойких и химически стойких полимеров и др.
Лит.: Фтор и его соединения, под ред. Дж. Саймонса, пер. с англ., т. 1–2, М., 1953–56; Шеппард У., Шартс К, Органическая химия фтора, пер. с англ., М., 1972; ИсикаваН., Кобаяси E., Фтор. Химия и применение, пер. с япон., М., 1982; Новые фторирующие реагенты в органическом синтезе, Новосиб., 1987; Промышленные фторорганические продукты. Справочник, Л., 1990.
Б. Н. Максимов
Фторирование неорг. соед. может осуществляться водными ("мокрыми") и неводными (термич., "сухими") методами. Реагентами для Ф. водными методами служат фтористоводородная кислота, кремнефтористоводородная кислота, растворы NH4F, NH4HF2, реже — растворы других фторидов металлов либо смеси CaF2, NaF, NH4HF2 с H2SO4 или др. кислотами. Таким путем получают чаще всего малорастворимые фториды (AlF3, UF4, ZrF4, CaF2, NaF) или фторометаллаты (Na3AlF4, Na2SiF6, K2TaF6). Из-за необходимости фильтрования, сушки, а для хорошо раств. фторидов и фторометаллатов — выпаривания выход продуктов низкий. Фториды, получаемые из водных растворов, как правило, имеют меньший размер частиц, меньшую насыпную плотность и более высокую степень чистоты, чем получаемые неводными методами. Водными методами не м. б. получены фториды, склонные к гидролизу и обладающие сильными окислит. свойствами.
Ф. неводными методами осуществляют с помощью газообразных (F2, HF, галогенфториды, NF3, CF4, хладоны, SF6), жидких (HF, HSO3F, галогенфториды, растворы NOF, NO2F и др. фторидов в HF, расплавы KHF2, KH2F3, NH4HF2) или твердых (NaF, CoF3, MnF4, Na2SiF6, K2SiF6) веществ.
Газообразные фторирующие агенты активируют с помощью УФ или ИК облучения (напр., лазерохим. активация SF6), катализа (введение в зону реакции твердых, реже газообразных катализаторов либо термокаталитич. генерирование атомного F) или разл. видов электрич. разряда (напр., разложение и ионизация CF4 или хладонов в плазме). Некоторые реакции проводят под давлением, реакции с участием ионизир. и атомизир. газов — в вакууме, отдельные процессы с участием F2- в режиме горения, напр., при получении UF6, SF6, XeF6 и др.
При газофазном Ф. фторируемые соед. м. б. в виде раствора в нелетучих инертных растворителях (жидкий HF при низких температурах, фторир. углеводороды) либо расплава (эвтектич. смесь LiF -NaF-KF).
Жидкие среды используют для электрохим. Ф., напр., электролизом расплава NH4HF2 получают NF3.
Неводные методы позволяют получать любые фториды и гидроксифториды, в т. ч. летучие, легко гидролизующиеся и обладающие окислит. действием.
Ф. происходит, как правило, постадийно с образованием сначала низших, затем высших фторидов. На промежут. стадии Ф. оксидов могут образовываться оксифториды, а при Ф. смесей веществ — фторометаллаты.
Ф. применяют в металлургии для получения фторидов редких и некоторых цветных металлов; для получения компонентов керамики, стекол, ситаллов и др. Ф. вместе с процессами пирогидролиза фторидов входит в прир. цикл фтора.
2) Искусственное обогащение питьевой воды, а также зубных паст и пищ. продуктов соед. фтора с целью регулирования его содержания в организме человека. Суточная доза фторид-иона для человека составляет 0,5–1,0 мг. Дефицит его ухудшает кроветворение, ослабляет защитные функции организма, вызывает заболевание кариесом. Избыток фторид-иона приводит к патологич. изменениям зубов и костей скелета, органов кроветворения, нервной и др. систем.
Ф. — одна из операций, применяемых при подготовке питьевой воды. Проводят на станциях водоочистки (при условии, что исходная концентрация фторид-иона менее 0,5 мг/л) путем растворения небольших количеств Na2SiF6 или NaF. Природные воды, напротив, подвергают обесфториванию. Для предотвращения кариеса фториды (SnF2, NaF и др.) вводят в качестве добавки в зубные пасты. В последнее время целесообразность Ф. воды ставится под сомнение.
Лит.: Руководство по неорганическому синтезу, под ред. Г. Брауэра, пер. с нем., т. 1, М., 1985; Раков Э.Г., Химия и технология неорганических фторидов, М., 1990.
Э. Г. Раков
Значения в других словарях
- фторирование — -я, ср. Действие по знач. глаг. фторировать. Искусственное фторирование воды. Малый академический словарь
- фторирование — орф. фторирование, -я Орфографический словарь Лопатина
- ФТОРИРОВАНИЕ — ФТОРИРОВАНИЕ, добавление неорганических фторидов в воду с целью предотвращения кариеса. В качестве добавки обычно используется фторид натрия в пропорции один к миллиону. Будучи впервые введено в 1930-е годы, фторирование с тех пор широко применяется во многих странах. Научно-технический словарь
- ФТОРИРОВАНИЕ — ФТОРИРОВАНИЕ — .. 1) введение в органическое соединение атома фтора, напр.: CH3COOH + SF4 ? CH3C(O)F. Об использовании фтора см. Галогенирование... Большой энциклопедический словарь
