трихлорэтилен
ТРИХЛОРЭТИЛЕН (трихлорэтен) ClCH = CCl2
мол. м. 131,39; бесцветная жидкость со сладковатым запахом; т. пл. −73 °C, т. кип. 86,7 °C; 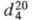 1,4642;
1,4642; 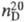 1,4773; pкрит5,02 МПа, tкрит 271 °C; η (мПа∙с) жидкости 0,90 ( −20 °C), 0,58 (20 °C), 0,37 (75 °C);
1,4773; pкрит5,02 МПа, tкрит 271 °C; η (мПа∙с) жидкости 0,90 ( −20 °C), 0,58 (20 °C), 0,37 (75 °C); 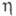 (мкПа∙с) пара 9,28 (20 °C), 11,90 (100 °C); γ (мН/м) 29,28 (20 °C), 24,4 (60 °C);
(мкПа∙с) пара 9,28 (20 °C), 11,90 (100 °C); γ (мН/м) 29,28 (20 °C), 24,4 (60 °C); 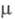 2,98∙10−30 Кл∙м; давление пара (кПа): 0,13 ( −43,8 °C), 2,68 (0 °C), 8,0 (20 °C), 40,75 (60 °C); C0p [кДж/(кг∙К)] жидкости 0,912 ( −40 °C), 0,962 (20 °C), 0,996 (60 °C), пара 0,594 (О °C), 0,657 (100 °C), 0,720 (300 °C);
2,98∙10−30 Кл∙м; давление пара (кПа): 0,13 ( −43,8 °C), 2,68 (0 °C), 8,0 (20 °C), 40,75 (60 °C); C0p [кДж/(кг∙К)] жидкости 0,912 ( −40 °C), 0,962 (20 °C), 0,996 (60 °C), пара 0,594 (О °C), 0,657 (100 °C), 0,720 (300 °C); 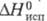 (кД/кг) 278,7 ( −20 °C), 262,8 (20 °C), 231,0 (100 °C),
(кД/кг) 278,7 ( −20 °C), 262,8 (20 °C), 231,0 (100 °C), 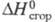 -962,32 кДж/моль,
-962,32 кДж/моль, 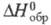 -7,53 кДж/моль; теплопроводность [Вт/(м∙К)] жидкости 0,142 ( −40 °C), 0,138 (20 °C), 0,099 (80 °C), пара 0,00833 (86,7 °C); ε 3,42 (16 °C). Хорошо раств. в органических растворителях. Растворимость в воде (% по массе): 0,017 (10 °C), 0,027 (20 °C), 0,125 (60 °C), растворимость воды в T. 0,02 (20 °C), 0,08 (60 °C). Образует азеотропную смесь с водой (т. кип. 73 °C, 7% воды). Энергии связей (кДж/моль):
-7,53 кДж/моль; теплопроводность [Вт/(м∙К)] жидкости 0,142 ( −40 °C), 0,138 (20 °C), 0,099 (80 °C), пара 0,00833 (86,7 °C); ε 3,42 (16 °C). Хорошо раств. в органических растворителях. Растворимость в воде (% по массе): 0,017 (10 °C), 0,027 (20 °C), 0,125 (60 °C), растворимость воды в T. 0,02 (20 °C), 0,08 (60 °C). Образует азеотропную смесь с водой (т. кип. 73 °C, 7% воды). Энергии связей (кДж/моль): 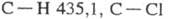 (для группы CHCl) 577,4.
(для группы CHCl) 577,4.
T. реагирует с хлором: в жидкой фазе в присутствии FeCl3 при 20–50 °C с образованием пентахлорэтана, в газовой фазе при 600 °C или в присутствии катализаторов (песок и др.) при 450–550 °C с образованием смеси тетрахлорэтилена и гекса-хлорэтана. T. присоединяет HCl в присутствии AlCl3; при этом происходит конденсация, полимеризация и осмоление. При взаимодействии со спиртовыми и конц. водными растворами щелочей, а также при пиролизе образуется дихлорацетилен. Гидролиз T. водными растворами щелочей при 150 °C приводит к гликолевой кислоте, а гидролиз H2SO4 — к монохлоруксусной кислоте; при восстановлении образуется 1,2-дихлорэтилен, в присутствии катализаторов (Ni, Pd, Pt) — этилен; при окислении O2 воздуха — дихлорацетилхлорид, фосген, CO и HCl (реакция ускоряется в присутствии I2, кислот или УФ света). Для стабилизации T. используют алкиламины, эпоксиды и др.
Совр. метод получения T. совместно с тетрахлорэтиленом — высокотемпературное хлорирование смеси хлорэтанов и хлорэтиленов (обычно отходы от производства винилхлорида, дихлорэтана) либо индивидуальных соед., напр., дихлор- или трихлорэтанов. Процесс проводят при 400–450 °C, как правило в кипящем слое катализатора (силикагель). Используют также окислит. хлорирование хлорэтанов и(или) хлорэтиленов в присутствии катализатора (CuCl2 и KCl на носителях — корунде, силикагеле и др.) при 350–400 °C.
Применяют T. для обезжиривания металлов, для хим. чистки текстильных изделий, ранее применяли для производства монохлоруксусной кислоты.
Т. — трудногорючий продукт, т. всп. 32 °C, т. самовоспл. 416 °C; КПВ 10,5–41,0%. ПДК в воздухе рабочей зоны 10 мг/м3, в воздухе населенных мест 1 мг/м3 (среднесуточная), в водоемах хозяйственно-бытового пользования 0,06 мг/л.
Мировое производство 500 тыс. т/год (1990).
Лит. см. при ст. тетрахлорэтаны.
Ю. А. Трегер
Значения в других словарях
- Трихлорэтилен — CCl2=CHCI, бесцветная жидкость с запахом, напоминающим запах хлороформа; tkип 87,2 °C, плотность 1,465 г/см3 (20 °C). Плохо растворяется в воде (0,11 г в 100 г при 25 °С), образует азеотропные смеси (См. Большая советская энциклопедия
- трихлорэтилен — орф. трихлорэтилен, -а Орфографический словарь Лопатина
- ТРИХЛОРЭТИЛЕН — ТРИХЛОРЭТИЛЕН — Cl2C = CHCl, бесцветная жидкость, tкип =87,2 °C. Растворитель для обезжиривания металлов, тканей, кожи; используется для экстракции жиров, при химической чистке одежды. Большой энциклопедический словарь
