сульфоксиды
СУЛЬФОКСИДЫ
соед. общей формулы RR'SO (R и R'-алкил, арил, аралкил и др.). Назв. ациклических С. производят от назв. двух орг. радикалов, связанных с атомом S, с прибавлением слова "сульфоксид"; назв. циклических С. производят от назв. соответствующего гетероцикла с окончанием "оксид", напр. тииран-1-оксид, или тиацшшопропан-1-оксид.
В природе С. найдены в некоторых растениях. Так, S-аллил-L-цистеинсульфоксид CH2=CHCH2S(O)CH2CH(NH2)COOH (аллиин) — в чесноке, сульфофарен CH3S(O)CH=CHCH2NCS — в семенах редиса, изотиоцианаты, содержащие группу SO, формулы CH3S(O)(CH2)nNCS (n = 3–11) — в растениях семейства крестоцветных.
Структура молекулы С. — искаженная пирамида. Для ди-метилсульфоксида (ДМСО) длины связей 0,147 нм (S—О), 0,182 нм (S—С), 0,108 нм (С—Н), углы OSC 107°, CSC 100°. Константы Гаммета для группы CH3SO σпара 0,51, σмета 0,48.
Несимметричные С. могут существовать в виде энантио-меров. Известны термич., фотохим. рацемизация и рацемизация под действием хим. реагентов, гл. обр. электро-филов.
В ИК спектрах С. присутствуют характеристич. полосы в области 1050–1060 см−1, соответствующие валентным колебаниям группы SO.
С. — бесцв. малолетучие жидкие или кристаллич. вещества (см. табл.), хорошо раств. в большинстве орг. растворителей; ДМСО и тетраметиленсульфоксид смешиваются с водой во всех отношениях.
СВОЙСТВА НЕКОТОРЫХ СУЛЬФОКСИДОВ
таблица в процессе добавления
С. — очень слабые основания, с сильными кислотами (HCl, HBr, HNO3) образуют соли типа R2SO ∙ HCl; под действием разл. реагентов, напр. H2O2, окисляются до сульфонов RR'SO2; под действием восстановителей (LiAlH4, NaBH4, H2 в присутствии Pd, дихлорборан, трихлорсилан, Ph3P и др.) образуют сульфиды RR'S.
Подобно карбонильным соед., конденсация С. с производными аминов и амидов приводит к сульфимидам RR'S=NR: (R''-алкил, арил, ацил), а при одновременном окислении — к сульфоксимидам RR'S(O)=NR:.
Нуклеоф. свойства С. проявляются в легкости образования алкокси- и гидроксисульфониевых солей, что используется, напр., для окисления бензил- и аллилгалогенидов или тозилатов:
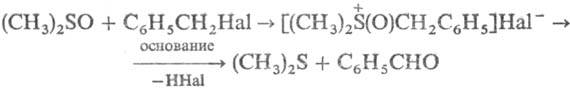
Под действием ангидридов карбоновых кислот С. превращ. в α-ацилтиоэфиры (перегруппировка Пуммерера); в случае несимметричных С. ацилоксигруппа присоединяется к наим. замещенному атому С., напр.:
(CH3)2CHS(O)CH3 + (CH3CO)2O → (CH3)2CHSCH2OCOCH3
С. подвергаются перегруппировке также под действием хлорангидридов карбоновых кислот, изоцианатов, неорг. галогенидов (SiCl4, PC13, SO2C12 и др.), напр.:
CH3S(O)CH3 + C6H5COCl → CH3SCH2Cl + C6H5COOH
При термолизе или в присутствии сильных оснований С. способны элиминировать сульфеновые кислоты, напр.:
PhCH(CH3)CH(Ph)S(O)Ph → PhC(CH3)=CHPh + [PhSOH]
Действие гидридов или алкоголятов металлов на С. приводит к реакционноспособным α-сульфинилкарбанионам типа RS(O)CH2; действие реагентов, генерирующих положительно заряженный галоген (NOCl, РhICl2, Cl2, Br2 и др.), — к α-галогенсодержащим С.
Получают С. окислением сульфидов (окислители: оксиды азота, растворы H2O2, м-хлорнадбензойная кислота, гипохлориты и др.); используют также реакции сульфинатов и С. с металлоорг. соединениями, перегруппировку эфиров сульфеновых кислот, присоединение монооксида S к полиенам.
Наиб. значение имеют диметилсульфоксид и нефтяные С., получаемые окислением серосодержащих компонентов нефти. Нефтяные С. — экстрагенты редких металлов, флотореа-генты цветных металлов.
Лит.: Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 253–318.
А. Ф. Елеев
Значения в других словарях
- Сульфоксиды — Сульфоокиси, Сераорганические соединения, содержащие группу , связанную с двумя органическими радикалами. С. — бесцветные вязкие жидкости или кристаллические вещества, например для диметилсульфоксида (CH3)2SO tпл 18,4 °С, tkип 189 °С... Большая советская энциклопедия
- сульфоксиды — орф. сульфоксиды, -ов, ед. -ксид, -а Орфографический словарь Лопатина
- СУЛЬФОКСИДЫ — СУЛЬФОКСИДЫ — соединения, содержащие группу — связанную с двумя органическими радикалами. Вязкие бесцветные жидкости или кристаллические вещества; растворяются в спирте и эфире. Диметилсульфоксид (СН3)2SО (tпл 18,5 °С) используют как растворитель. Большой энциклопедический словарь
