рубидий
РУБИДИЙ (от лат. rubidus — красный; rubidium) Rb
хим. элемент I гр. периодической системы, ат. н. 37, ат. м. 85,4678; относится к щелочным металлам. В природе встречается в виде смеси стаб. изотопа 85Rb (72,15%) и радиоактивного 87Rb (27,85%; Т1/2 4,8∙1010лет, β-излучатель). Поперечное сечение захвата тепловых нейтронов для прир. смеси 0,73∙10−28 м2. Конфигурация внеш. электронной оболочки атома 5s1; степень ркисления +1; энергии ионизации Rb0 : Rb+ : Rb2+ 4,17719 эВ, 27,5 эВ; сродство к электрону 0,49 эВ; электроотрицательность по Полингу 0,8; работа выхода электрона 2,16 эВ; металлич. радиус 0,248 нм, ко-валентный радиус 0,216 нм, ионный радиус Rb+ 0,166 нм (координац. число 6), 0,186 нм (12).
Содержание Р. в земной коре 1,5∙10−2% по массе. Собств. минералов не образует, в природе находится в рассеянном состоянии. Встречается в виде примеси в минералах К (карналлите и сильвине) и в богатых К алюмосиликатах-лепидолите, циннвальдите, биотите, амазоните, петалите и др., а также в трифилине; присутствует в минералах Cs-поллу-ците и редком авогадрите; находится в минер. источниках, озерной, морской и подземных водах. Осн. пром. запасы Р. сконцентрированы в лепидолите (0,09–3% по массе в расчете на Rb2O), циннвальдите (0,16–1,7%), поллуците (0,3–1,2%), карналлите (0,015–0,040% по массе в расчете на RbCl). Перспективные сырьевые источники Р. — нефелиновые руды (0,02–0,03% по массе Rb2O), биотит (0,06–0,4%), флогопит (0,04–0,2%) и некоторые др. слюды и слюдяные хвосты, получаемые на обогатит. фабриках при разработке берилловых и флюоритовых месторождений, а также прир. высокоминерализов. воды.
Свойства. Р. — мягкий серебристо-белый металл, при обычной температуре имеет почти пастообразную консистенцию, пары окрашены в зеленовато-синий цвет. Кристаллизуется в объемноцентрир. кубич. решетке, а — 0,570 нм, z = 2, пространственная группа Iт3т. Т.пл. 39,32 °C, т. кип. 687,2 °C; плотн. 1,532 г/см3 (0 °C), 1,4718 г/см3 (687,2 °C); 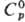 31,1 Дж/(моль∙К);
31,1 Дж/(моль∙К); 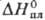 2,19 кДж/моль,
2,19 кДж/моль, 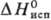 70 кДж/моль, 80,9
70 кДж/моль, 80,9 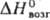 кДж/моль;
кДж/моль;  76,8 Дж/(моль∙К); уравнения температурной зависимости давления пара: lgp (мм рт. ст.) = — 4296/Т+ 6,619 — — 0,8541g Т+ 2863Т (100–312 К), lgp (мм рт. ст.) = = -4006/Т+ 6,154 — 0,309 lgT(312–955 К); теплопроводность [Вт/(м∙К)] 35,6 (293 К), 31,41 (323 К), 34,35 (493 К); температурный коэф. линейного расширения 9∙10−5K−1 (273–303 К); ρ (мкОм∙м) 0,1125 (273 К), 0,1351 (312 К, твердый), 0,2153 (312 К, жидкий), 0,2906 (400 К), 0,4762 (600 К), температурный коэф. ρ 4,7∙10−3 К−1 (273–293 К) при плавлении возрастает в 1,6 раза; уд. магн. восприимчивость + 0,198∙10−9 (303–373 К); γ 92,63 мН/м (313 К); давление истечения 0,78 МПа (295 К); η (мПа∙с) 6,43 (312,47 K), 4,37 (400 К), 1,69 (900 К). Твердость по Моосу 0,3; модуль упругости 2,35 ГПа; сжимаемость 40,5∙10−11 Па−1.
76,8 Дж/(моль∙К); уравнения температурной зависимости давления пара: lgp (мм рт. ст.) = — 4296/Т+ 6,619 — — 0,8541g Т+ 2863Т (100–312 К), lgp (мм рт. ст.) = = -4006/Т+ 6,154 — 0,309 lgT(312–955 К); теплопроводность [Вт/(м∙К)] 35,6 (293 К), 31,41 (323 К), 34,35 (493 К); температурный коэф. линейного расширения 9∙10−5K−1 (273–303 К); ρ (мкОм∙м) 0,1125 (273 К), 0,1351 (312 К, твердый), 0,2153 (312 К, жидкий), 0,2906 (400 К), 0,4762 (600 К), температурный коэф. ρ 4,7∙10−3 К−1 (273–293 К) при плавлении возрастает в 1,6 раза; уд. магн. восприимчивость + 0,198∙10−9 (303–373 К); γ 92,63 мН/м (313 К); давление истечения 0,78 МПа (295 К); η (мПа∙с) 6,43 (312,47 K), 4,37 (400 К), 1,69 (900 К). Твердость по Моосу 0,3; модуль упругости 2,35 ГПа; сжимаемость 40,5∙10−11 Па−1.
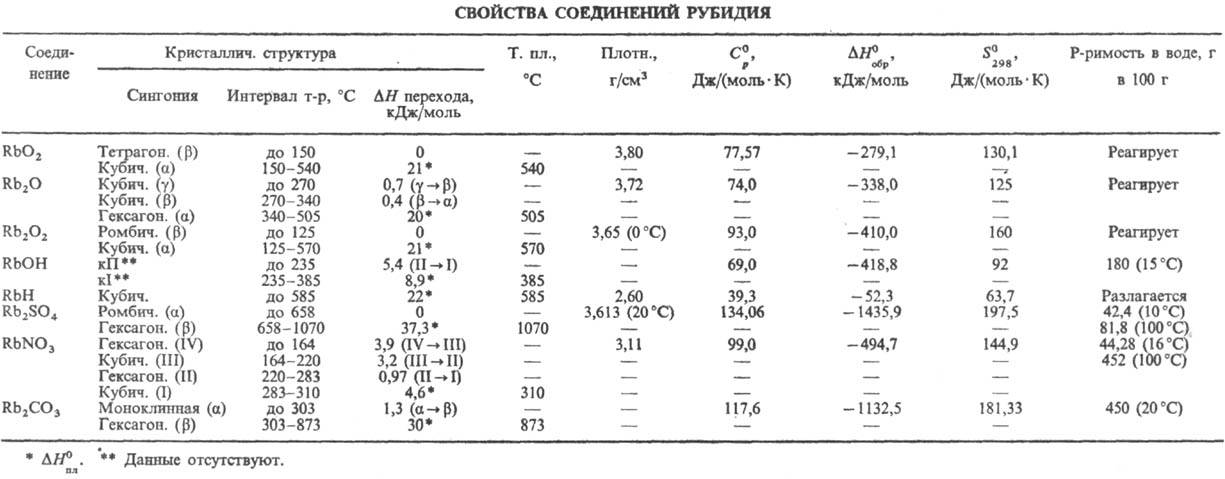
Р. обладает высокой реакц. способностью. Стандартный электродный потенциал —2,925 В. В O2 и на воздухе мгновенно окисляется с воспламенением, образуя надпероксид RbO2 с примесью пероксида Rb2O2. При ограниченном доступе O2 окисляется до оксида Rb2O. С водой реагирует обычно со взрывом с образованием гидроксида RbOH и выделением H2. Взаимод. с сухим H2 при нагр. под давлением 5–10 МПа в присутствии катализатора с образованием гидрида RbH. Непосредственно соединяется с галогенами, давая рубидия галогениды. Образование сульфида Rb2S при растирании Р. с порошком S сопровождается взрывом. При сплавлении Р. в вакууме с Se и Те получают соотв. селенид Rb2Se и теллурид Rb2Te. С N2 в обычных условиях не взаимод., с жидким N2 в электрич. разряде между электродами, изготовленными из Р., образует нитрид Rb3N. P. раств. в жидком NH3, алкиламинах и некоторых полиэфирах, давая синие растворы, содержащие сольватир. электроны и обладающие электронной проводимостью. С сухим газообразным NH3 P. при 200–300 °C образует амид RbNH2, с красным P при 400–430 °C-фосфид Rb2P5, с порошком графита при 200–350 °C — карбид C8Rb, а при более высоких T-pax-C24Rb, с ацетиленом — ацетиленид Rb2C2, с Si и Ge в атмосфере Ar при 600 °C — соотв. силицид RbSi и германид RbGe. P. взаимод. с CO2, CCl4 и CHCl3 со взрывом, выше 300 °C разрушает стекло, восстанавливая SiO2 и силикаты до Si. P. реагирует со всеми кислотами, в т. ч. с орг., с образованием соответствующих солей, со спиртами дает алкоголяты. Свойства соединений Р. представлены в таблице.
Р. образует сплавы со щелочными металлами, состоящие из твердых растворов (с К и Cs), расслаивающихся компонентов (с Li) или содержащие эвтектич. смеси (с Na). Интерметаллиды существуют в системах Р. со мн. металлами-Au, Hg, Cd, Ga, In, Sn, Pb, Bi и др., исключая тугоплавкие металлы.
Получение. Р. извлекают при переработке минер. сырья на др. ценные компоненты. Получаемые концентраты Р. содержат также соед. К (в превосходящем количестве) и Cs. Далее проводят хим. обогащение концентрата с получением техн. соединений Р. и очистку последних от примесей соед. К и Cs.
Большую часть Р. получают при переработке лепидолита на соед. Li. P. осаждают из маточных растворов (после выделения Li2CO3 или LiOH) в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов общей формулы MAl(SO4)2∙ 12H2O. Смесь разделяют методом фракционир. кристаллизации. Др. источник Р. — отработанный электролит, получающийся при переработке карналлита на Mg. Из него Р. выделяют сорбцией на осадках ферроцианидов Fe или Ni; далее ферроцианиды прокаливают и получают Rb2CO3 с примесями К и Cs. Более эффективна сорбция на гранулир. ферроцианидах в хроматографич. колонках с послед. элюированием водным раствором NH4C1. При переработке поллуцита на соед. цезия Р. извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Возможно извлечение Р. из технол. растворов переработки нефелина на глинозем.
Перспективен метод извлечения Р. ионообменной хроматографией на синтетич. смолах и неорг. ионитах (кли-ноптилолит, глауконит, фосфаты Zr), а также экстракцией производными фенола [4-втор-бутил-2-(α-метилбензил)фенол, алкилфенолы C7—C9 и др.]. Для получения соединений Р. высокой чистоты используют его полигалогениды.
Металлический Р. получают в осн. восстановлением RbHal магнием или кальцием (600–800 °C, ~ 0,1 Па) с послед, очисткой от примесей ректификацией и вакуумной дистилляцией. Можно получить Р. электрохим. способом из расплава RbHal на жидком свинцовом катоде, из образовавшегося свинцово-рубидиевого сплава Р. выделяют дистилляцией в вакууме. В небольших количествах Р. получают восстановлением Rb2CrO4 порошком Zr или Si, а Р. высокой чистоты-путем медленного термич. разложения RbN3 в вакууме (менее 0,1 Па) при 390–395 °C.
Определение. Качественно Р. обнаруживают по очень яркой спектральной линии 780,023 нм, в отсутствие К и Cs-также по образованию RbClO4, Rb2[PtCl6], Rb2[SnI6], RbOC6H2(NO2)3. Количественно Р. определяют в осн. методами фотометрии пламени или атомно-абсорбц. спектроскопии по резонансным линиям 780,023 и 794,760 нм. Применяют также радиохим. метод изотопного разбавления и нейтронно-активационный. Хим. методы количеств. определения Р. требуют предварит. удаления К и Cs. В отсутствие К и Cs Р. определяют гравиметрически в форме RbClO4, Rb2[PtCl6], Rb[B(C6H5)4], а также титриметрически.
Применение. Металлический Р. — компонент материала катодов для фотоэлементов и фотоэлектрич. умножителей, геттер в вакуумных лампах, входит в состав смазочных композиций, используемых в реактивной и космич. технике, применяется в гидридных топливных элементах, катализатор. Пары Р. используют в разрядных электрич. трубках, лампах низкого давления — источниках резонансного излучения, в чувствит. магнитометрах, стандартах частоты и времени. Перспективно использование Р. в качестве металлич. теплоносителя и рабочей среды в ядерных реакторах и турбоэлектрич. генераторных установках. Соединения Р. — компоненты спец. стекол и керамики, Rb2O входит в состав сложных фотокатодов.
Мировое производство Р. и его соед. (без СНГ) ок. 450 кг/год (1979).
Р. опасен в обращении, хранят его в ампулах из стекла пирекс в атмосфере Ar или в стальных герметичных сосудах под слоем обезвоженного масла (вазелинового, парафинового). Утилизируют Р. обработкой остатков металла пентанолом.
Р. открыли в 1861 Р. Бунзен и Г. Кирхгоф.
Лит.: Коган Б. И., Названова В. А., Солодов H. А., Рубидий и цезий, М., 1971; Плющев В. Е., Степин Б. Д., Аналитическая химия рубидия и цезия, М., 1975. См. также лит. при ст. литий.
Л. И. Покровская
Значения в других словарях
- Рубидий — (лат. Rubidium) Rb, химический элемент I группы периодической системы Менделеева; атомный номер 37, атомная масса 85,4678; серебристо-белый металл, относится к щелочным металлам (См. Щелочные металлы). Природный... Большая советская энциклопедия
- рубидий — -я, м. Химический элемент, мягкий металл серебристо-белого цвета, по своим свойствам сходный с калием и натрием. [От лат. rubidus — красноватый] Малый академический словарь
- рубидий — Руби́д/ий/. Морфемно-орфографический словарь
- рубидий — орф. рубидий, -я Орфографический словарь Лопатина
- Рубидий — Rb (a. rubidium; н. Rubidium; ф. rubidium; и. rubidio), — хим. элемент I группы периодич. системы Менделеева, ат. н. 37, ат. м. 85,4678; относится к щелочным металлам. Горная энциклопедия
- рубидий — РУБ’ИДИЙ, рубидия, ·муж. (от ·лат. rubidus — красноватый). Химический элемент — мягкий металл серебристо-белого цвета, по свойствам сходный с калием и натрием. Толковый словарь Ушакова
- рубидий — РУБИДИЙ -я; м. [от лат. rubidus — красноватый] Химический элемент (Rb), мягкий металл серебристо-белого цвета, по своим свойствам сходный с калием и натрием. ◁ Рубидиевый, -ая, -ое. Толковый словарь Кузнецова
- рубидий — Рубидия, м. [от латин. rubidus – красноватый]. Химический элемент – мягкий металл серебристо-белого цвета, по свойствам сходный с калием и натрием. Большой словарь иностранных слов
- РУБИДИЙ — РУБИДИЙ (лат. Rubidium) — Rb, химический элемент I группы периодической системы Менделеева, атомный номер 37, атомная масса 85,4678. Относится к щелочным металлам. Название от лат. rubidus — темно-красный (открыт по линиям в красной части спектра). Большой энциклопедический словарь
- рубидий — рубидий м. Химический элемент, мягкий металл серебристо-белого цвета, сходный по своим свойствам с калием и натрием. Толковый словарь Ефремовой
- Рубидий — (хим.; Rubidium; Rb = 85,44 при O = 16, среднее из определений Бунзена, Пикара и Годефруа) — второй металлический элемент (см. Цезий), открытый (в 1861 г.) Бунзеном и Кирхгоффом с помощью спектрального анализа (см. Энциклопедический словарь Брокгауза и Ефрона
