пропиленоксид
ПРОПИЛЕНОКСИД (метилоксиран, 1,2-пропиленоксид)
мол. м. 5,08; бесцв. прозрачная жидкость; т. пл. −112 °C, т. tкриткип. 34,3 °C, 0 °C/210∙мм рт. ст.; 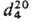 0,8311; 1,3660;
0,8311; 1,3660; 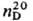 tкрит 209,15 °C, ркрит 4,92 МПа; η 0,28 мПа∙с (25 °C), 0,41 мПа∙с (0 °C); μ 6,61∙10−30 Кл∙м: С_ 1,97 кДж/(кг∙К);
tкрит 209,15 °C, ркрит 4,92 МПа; η 0,28 мПа∙с (25 °C), 0,41 мПа∙с (0 °C); μ 6,61∙10−30 Кл∙м: С_ 1,97 кДж/(кг∙К); 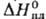 6,54 кДж/моль,
6,54 кДж/моль, 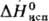 27,92 кДж/моль,
27,92 кДж/моль, 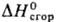 −191 кДж/моль,
−191 кДж/моль, 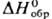 −92,82 кДж/моль (жидкость); уравнение температурной зависимости давления пара: lgp (мм. рт. ст.) = 1722,7/T+ + 8,48 (243–306 К). Раств. в большинстве орг. растворителей; в воде при 10 °C раств. 40,8% по массе П., при 20 °C-40,1%. В П. при 10 °C раств. 10,4% H2O, при 20 °C-12,4%. При повыш. давлении П. с водой образует азеогропы: т. кип. 69 °C (0,2 МПа, 0,1% по массе H2O) и т. кип. 86,5 °C (0,4 МПа, 0,2% H2O). При пониж. температурах кристаллизуется гидрат C3H6О∙16H2O, т. пл. −3 °C.
−92,82 кДж/моль (жидкость); уравнение температурной зависимости давления пара: lgp (мм. рт. ст.) = 1722,7/T+ + 8,48 (243–306 К). Раств. в большинстве орг. растворителей; в воде при 10 °C раств. 40,8% по массе П., при 20 °C-40,1%. В П. при 10 °C раств. 10,4% H2O, при 20 °C-12,4%. При повыш. давлении П. с водой образует азеогропы: т. кип. 69 °C (0,2 МПа, 0,1% по массе H2O) и т. кип. 86,5 °C (0,4 МПа, 0,2% H2O). При пониж. температурах кристаллизуется гидрат C3H6О∙16H2O, т. пл. −3 °C.
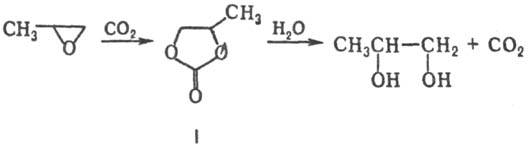
П. — один из наиболее распространенных оксидов олефинов (см. олефинов оксиды). Для него характерны реакции присоединения, обусловленные относит. легкостью размыкания цикла. Наиб. распространенная реакция-гидратация с образованием пропиленгликоля. Побочные продукты ди-, три- и полигликоли. Гидратация П. с использованием CO2 (120–160 °C, 0,5–4 МПа) протекает селективно с образованием монопропиленгликоля (кат. — четвертичные соли аммония и фосфония, третичные амины, галогениды щелочных металлов); промежуточно образуется пропиленкарбонат (I):
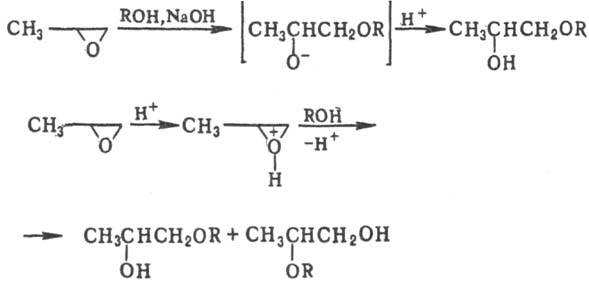
Со спиртами и фенолами П. образует простые эфиры гликолей: в присутствии щелочей-преим. первичный эфир, в при-сут. кислот — смесь первичного и вторичного эфиров в равном отношении:
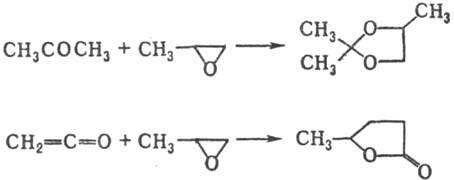
При взаимодействии с карбоновыми кислотами в присутствии солей щелочных металлов П. превращ. в гидроксизамещенные сложные эфиры; при взаимодействии с галогеноводородами дает соответствующие галогенгидрины, с NH3-моно-, ди- или триизопропаноламины. Гидрирование в присутствии N1 приводит к 1-пропанолу, восстановление амальгамой Na, Na в жидком NH3 или LiAlH4 — к изопропанолу. С альдегидами и кетонами П. образует циклич. ацетали, с кетенами γ-лактоны, напр.:
Изомеризация П. при 240–500 °C в присутствии SiO2, A12O3, пемзы и др. катализаторов идет с образованием смеси пропионового альдегида, ацетона и аллилового спирта.
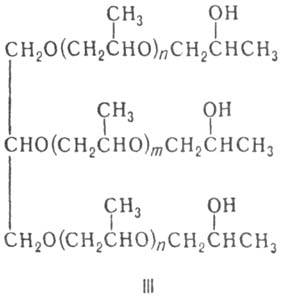
В присут. разл. катализаторов (щелочи, кислоты Льюиса, металлоорг. соед., амины, спирты, фенолы) П. легко полимеризуется в полипропиленоксид [—OCH2CH(CH3)—]n с мол. массой до неск. миллионов. Полимеризация П. в массе в присутствии пропиленгликоля при 100–160 °C приводит к поли-пропиленгликолю (формула II); в присутствии глицерина, пента-эритрита или сорбита — к полиоксипропиленполиолам, напр. соед. III в случае глицерина.
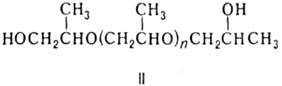
При сополимеризации с этиленоксидом и пропиленгликолем в присутствии щелочных катализаторов или этилендиами-на П. образует блоксополимеры — соотв. проксанолы или проксамины. В растворе П. легко сополимеризуется с аллилгли-цидовым эфиром с образованием пропиленоксидного каучука.
Получают П. гл. обр. хлоргидринным и пероксидным методами. Схема хлоргидринного метода:
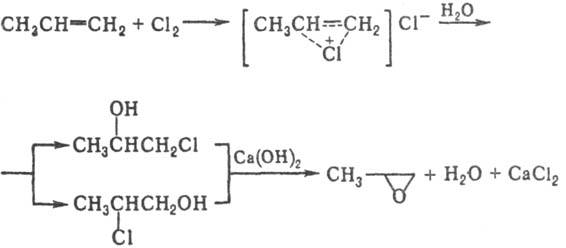
Пропилен и Cl2 смешивают в эквимолярных количествах с избытком H2O (4-7-кратный); реакцию проводят при 35–40 °C, поддерживая концентрацию пропиленхлоргидрина не более 4–6% по массе для уменьшения количества побочных продуктов-дихлорпропана и дихлорпропилового эфира. Избыток пропилена отделяют и возвращают в реакцию. На след. стадии при комнатной температуре водный раствор смеси пропи-ленхлоргидринов обрабатывают избытком известкового молока-раствора Ca(OH)2. Образующийся П. отгоняют для предотвращения гидратации в гликоль. Недостаток процесса — использование Cl2 и образование больших количеств разб. (5–6%) раствора CaCl2. Наиб. экономичная разновидность процесса — комбинирование с электролитич. производством Cl2 и NaOH; при этом гидролиз пропиленхлоргидрина осуществ-ляют при 80 °С раствором NaOH после электролиза, а образующийся раствор NaCl используют для растворения NaCl, направляемого на электролиз.
Пероксидный способ синтеза П. основан на окислении олефинов надкислотами (Прилежаева реакция) и гидропероксидами изобутана и этилбензола. В первом варианте синтеза П. образуется при взаимодействии пропилена с надуксус-ной или надпропионовой кислотой, получаемыми окислением ацетальдегида или пропионовой кислоты; соотв. этот вариант синтеза не находит широкого применения. Второй вариант синтеза осуществляют по схемам 1 и 2:
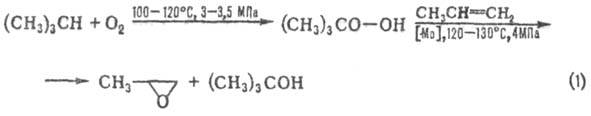
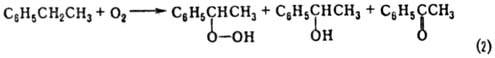
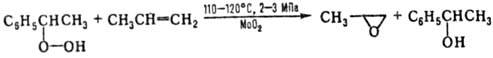
Селективность превращения в П.-90–99%.
Иногда применяют также эпоксидирование пропилена гидропероксидом пропилбензола (кумольный метод).
П. — исходное сырье для получения пропиленгликоля, про-пиленкарбоната, изопропаноламинов, полиоксипропилен-полиолов, полипропиленоксида, пропиленоксидных каучуков, пропиленсульфида, некоторых ПАВ; промежут. продукт в синтезе эфиров пропиленгликоля, эпихлоргидриновых кау-чуков, полиуретанов и полиэфирных смол.
П. — горючая жидкость; КПВ 2,1–21,5% по объему. ПДК 1 мг/м3.
П. обладает цитотоксичным и мутагенным действием, вызывает расстройства гемодинамики; ЛД50 580 мг/кг (мыши, внутрижелудочно).
Объем мирового производства ок. 3 млн.т/год (1987).
Лит.: Kirk — Othraer encyclopedia, 3 ed., v. 19, N.Y., 1982, p. 246–74.
Б. Б. Чесноков
Значения в других словарях
- ПРОПИЛЕНОКСИД — ПРОПИЛЕНОКСИД (окись пропилена) — бесцветная жидкость, tкип 34,2 °С. Применяется главным образом для синтеза поверхностно-активных веществ, а также полимеров; фумигант. Большой энциклопедический словарь
