нуклеиновые кислоты
НУКЛЕИНОВЫЕ КИСЛОТЫ (полинуклеотиды)
биополимеры, осуществляющие хранение и передачу генетич. информации во всех живых организмах, а также участвующие в биосинтезе белков.
Первичная структура Н.к. представляет собой последовательность остатков нуклеотидов. Последние в молекуле Н.к. образуют неразветвленные цепи. В зависимости от природы углеводного остатка в нуклеотиде (D-дезоксирибозы или D-рибозы) Н.к. подразделяют соотв. на дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК) кислоты. В молекуле ДНК гетероциклы, входящие в остаток нуклеотида, представлены двумя пуриновыми основаниями — аденином (А) и гуанином (G), и двумя пиримидиновыми основаниями — тимиком (Т) и цитозином (С); РНК вместо Т содержит урацил (U). Кроме того, в Н.к. в небольших количествах обнаруживаются модифицированные (в осн. метилированные) остатки нуклеозидов- т. наз. минорные нуклеозиды, которыми особенно богаты транспортные рибонуклеиновые кислоты (тРНК). Отдельные нуклеотидные остатки связаны между собой в полинуклеотидных цепях 3'-5'-фосфодиэфирными связями (см. формулу). Стандартная запись нуклеотидной последовательности осуществляется в направлении от 5'-конца к 3'-концу (каждый нуклеотид обозначают буквой, присвоенной основанию, которое он содержит; напр., последовательность приведенного участка ДНК записывается как ACGT).
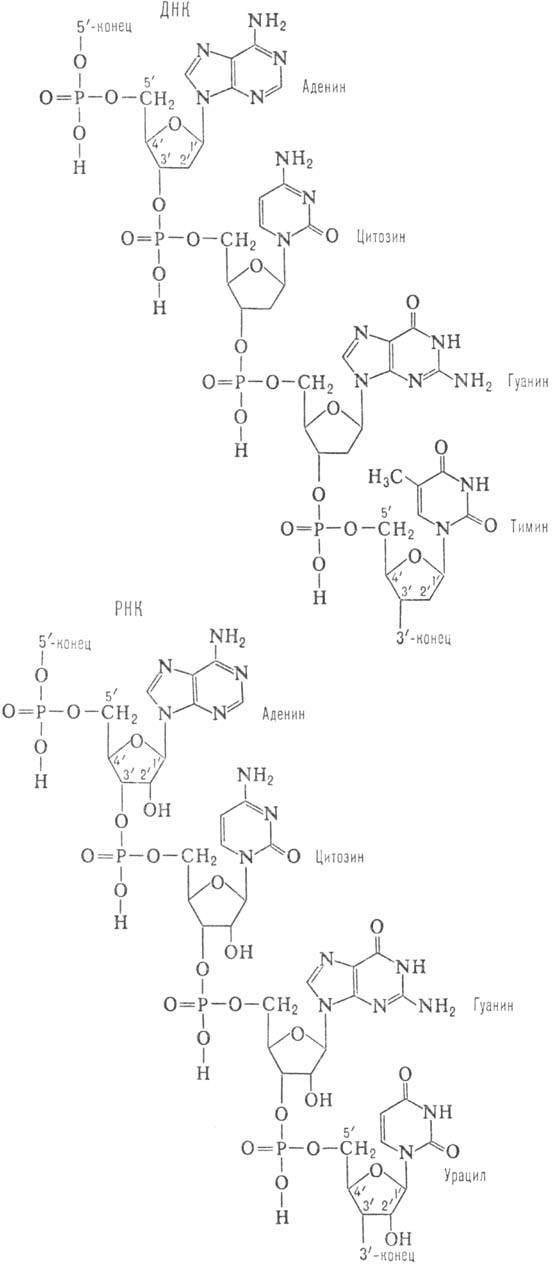
Свойства ДНК и РНК различны. Так, РНК легко расщепляется щелочами до мононуклеотидов (благодаря наличию группы 2'-ОН), в то время как полинуклеотидные цепи ДНК в тех же условиях стабильны. Это структурное различие определяет и меньшую устойчивость к воздействию кислот N-гликозидных связей (связь между гетероциклом и остатком рибозы) в ДНК по сравнению с РНК.
Дсзоксирибонуклепновые кислоты. Нуклеотидный состав ДНК подчиняется ряду правил (т. наз. п р а в и л а Ч а р г а ф ф а), важнейшее среди которых — одинаковое содержание А и Т, G и С у любой клеточной ДНК. Нуклеотидный состав РНК подобным правилам не подчиняется.
Пространствю структура ДНК описывается как комплекс двух полинуклеотидных антипараллельных цепей (рис. 1), закрученных относительно общей оси, так что углевод-фосфатные цепи составляют периферию молекулы, а азотсодержащие гетероциклы направлены внутрь (д в о й н а я с п и р а л ь У о т с о н а — К р и к а). Антипараллельность полинуклеотидных цепей выражается в том, что на одном и том же конце спирали одна полинуклеотидиая цепь содержит (незамещенную или замещенную) группу 5'-ОН, а другая 3'-ОН. Фундам. свойство двойной спирали ДНК состоит в том, что ее цепи комплементарны друг другу (см. комплементарность) вследствие того, что напротив А одной цепи всегда находится Т другой цепи, а напротив G всегда находится С. Комплементарное спаривание А с Т и G с С осуществляется посредством водородных связей. Классич. двойная спираль Уотсона-Крика получила назв. В-формы ДНК. Она — правозакрученная, плоскости гетероциклич. оснований перпендикулярны оси спирали, а число пар остатков нуклеотидов на один виток спирали равно примерно 10; расстояние между витками 3,4 нм. При изменении ионной силы и состава растворителя двойная спираль изменяет свою форму и даже может превращ. в левозакрученную спираль (т. наз. Z-форму), которая содержит в одном витке ок. 12 остатков нуклеотидов. При дегидратации В-формы образуется А-форма ДНК-правозакрученная двойная спираль, содержащая в одном витке ок. 11 остатков нуклеотидов, плоскости гетероциклич. оснований повернуты примерно на 20° относительно перпендикуляра к оси спирали. Двойная спираль ДНК способна денатурировать (напр., при повышении температуры) с полным расхождением комплементарных цепей, которые сохраняют способность к ассоциации с восстановлением (рекатурацией) двойной спирали при возвращении к исходным условиям. Подробно изучены также конформации фрагментов ДНК.
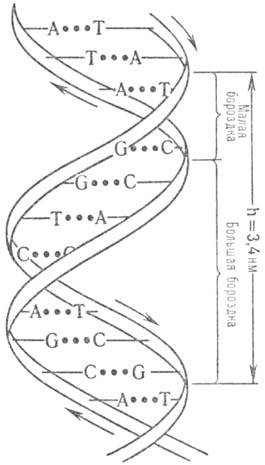
Рис. 1. Двойная спираль ДНК (стрелками показано направление полинуклеотидной цепи).
Установлено, что молекула ДНК в клетке представляет собой совокупность генов, регуляторных участков (последовательностей, связывающихся с регуляторными белками и управляющих уровнем экспрессии генов), районов, участвующих в организации генов в хромосомах, а также последовательностей, функции которых еще не известны.
У прокариот (бактерии и синезеленые водоросли) ДНК организована в виде компактного образования — н у к л е о и д а, который содержит всю хромосомную ДНК клетки длиной в неск. миллионов пар нуклеотидов (м∙п.н.). Кроме того, у мн. прокариот и эукариот (все организмы, за исключением прокариот) обнаружены нехромосомные ДНК (т. наз. плазмиды) размером от неск. тысяч пар нуклеотидов (т.п.н.) до неск. десятков т.п.н. (м∙п.н. и т. п.н.-принятые единицы длины двухцепочечной молекулы Н.к.) —
Мн. ДНК образуют кольцевые структуры. В том случае, если обе полинуклеотидные цепи ДНК ковалентно непрерывны, ДНК может находиться в сверхспирализованной (сверхскрученной) форме (рис. 2). В клетках сверхспирализация осуществляется ферментами ДНК-гиразами (топоизомеразами II).
Хромосомные ДНК эукариот локализованы в клеточном ядре, где вместе с гистонами и негистоновыми белками образуют хроматин — нуклеопротеид, из которого организованы хромосомы. Размеры ДНК в отдельных эукариотич. хромосомах колеблются в широких пределах — от 103 до 105 т.п.н.
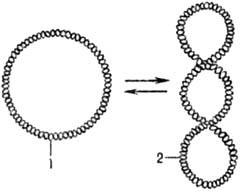
Рис. 2. Сверхспирализация двухцепочечной кольцевой ДНК под действием ДНК-гиразы: 1 — кольцевая форма ДНК; 2 — сверхспирализованная форма ДНК.
Геномы мн. вирусов бактерий (бактериофагов), животных и в более редких случаях растений представлены ДНК. Такие клеточные органеллы, как митохондрии и хлоропласты, имеют также свою собственную ДНК размером от неск. десятков до неск. сотен т.п.н.
Биосинтез ДНК осуществляется в результате репликации-точного самокопирования (самовоспроизведения) путем синтеза новой молекулы ДНК на исходной ("материнской"), которая играет роль матрицы. Этот процесс осуществляется под действием фермента ДНК-полимеразы. Матрицей для синтеза ДНК может служить также однотяжевая (одноцепочечная) РНК, комплементарное копирование которой осуществляет фермент обратная транскриптаза.
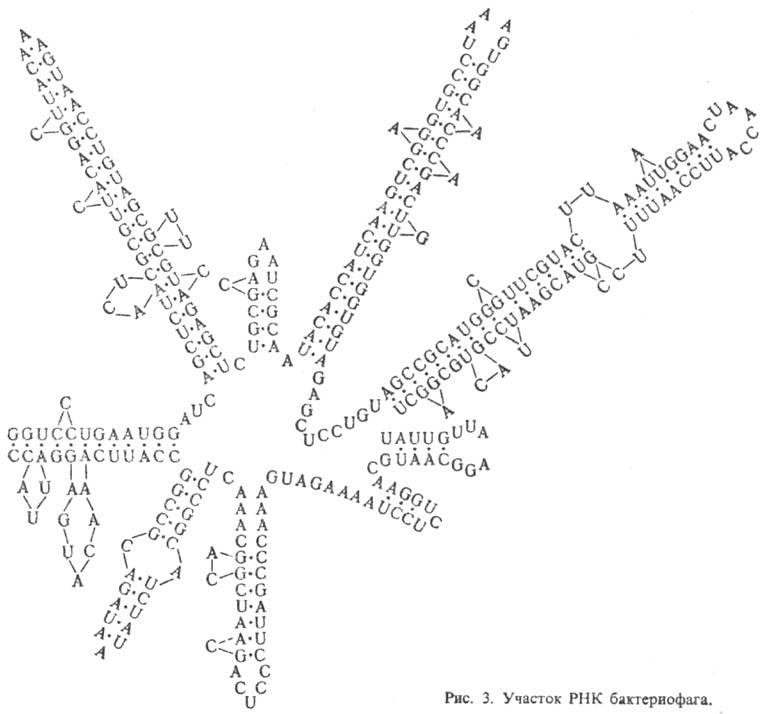
Рибонуклеиновые кислоты. РНК, как правило, построены из одной полинуклеотидной цепи, характерный элемент вторичной структуры которой — "шпильки", перемежающиеся однотяжевыми участками (рис. 3). Шпилька — двутяжевая спиральная структура, образующаяся в результате комплементарного спаривания оснований (А с U и G с С). Шпильки и соединяющие их однотяжевые участки РНК укладываются в компактную третичную структуру. Для тРНК вторичная структура имеет характерную форму, которую наз. "клеверным листом". Известны редкие примеры целиком двухспиральных молекул РНК.
Двухспиральные гибридные комплексы (ДНК и РНК) м. б. искусственно получены из комплементарных однотяжевых ДНК и РНК. Функциональноактивные РНК имеют размер от 70–150 до неск. тысяч нуклеотидных остатков. Биосинтез РНК (транскрипция) обычно происходит в результате комплементарного копирования ДНК-матрицы, которое осуществляет фермент РНК-полимераза.
Известно неск. типов РНК. Рибосомные рибонуклеиновые кислоты, связываясь с рибосомными белками, образуют рибосомы, в которых осуществляется синтез белка. Матричные рибонуклеиновые кислоты служат матрицами для синтеза белков (трансляции). тРНК осуществляют связывание соответствующей аминокислоты и ее перенос к рибосомам. Обнаружены т. наз. малые ядерные РНК, участвующие в превращ. первичных продуктов транскрипции в функционирующие молекулы; т. наз. антисмысловые РНК участвуют в регуляции биосинтеза белка и репликации плазмидных ДНК. В виде РНК представлены геномы мн. вирусов (РНК-содержащие вирусы), в которых матрицами для синтеза РНК служат вирусные РНК. Некоторые РНК обладают ферментативной активностью, катализируя расщепление и образование фосфодиэфирных связей в своих собственных или др. молекулах РНК.
Определение первичной структуры (секвенирование) Н.к. Секвенирование Н.к. позволяет определить в одном эксперименте последовательность нуклеотидов в ДНК или РНК, содержащих неск. сотен мономерных звеньев. Методы основаны на общем принципе — определении с помощью высокоразрешающего электрофореза в полиакриламидном геле с точностью до одного нуклеотида длины всех возможных фрагментов секвенируемого участка Н.к., содержащих на одном конце одну и ту же последовательность нуклеотидов (гомогенный фрагмент), а на другом — один и тот же нуклеотид. Такие фрагменты получают двумя разл. способами. В первом случае (метод Максама — Гилберта) гомогенный фрагмент ДНК или РНК, предварительно меченный радиоактивной меткой по одному из концов, расщепляют хим. агентами, специфичными к одному из четырех нуклеотидных остатков (A, G, С, Т или U); в случае РНК этот процесс осуществляют также специфич. рибонуклеазами. Расщепление ведут в таких ограничивающих условиях, когда в каждой молекуле Н.к. расщепляется только одна межнуклеотидная связь рядом с нуклеотидом данного типа, независимо от его положения в цепи. Такую операцию проводят для каждого из четырех нуклеотидных остатков и по длинам образующихся радиоактивных фрагментов определяют положение каждого нуклеотида в цепи Н.к.
В др. случае (м е т о д С е н г е р а) используют олиго- или полинуклеотидную затравку (праймер) известной длины, коплементарную определенному участку Н.к. Затравку наращивают с помощью ДНК-полимеразы, останавливая синтез на одном из четырех типов нуклеотидных остатков с равной вероятностью, независимо от его положения в цепи. Для этого к смеси четырех прир. субстратов ДНК-полимеразы добавляют т. наз. терминатор (обычно 2', 3'-дидезоксинуклеозидтрифосфат) — аналог определяемого нуклеотидного остатка, попадание которого на 3'-конец растущей цепи останавливает синтез. При этом радиоактивная метка вводится либо в затравку, либо в субстрат. Операцию повторяют для каждого из четырех нуклеотидов; длину образующихся радиоактивных фрагментов определяют стандартным способом. Эти методы в настоящее время удалось полностью автоматизировать (заменив в ряде случаев радиоактивную метку на флуоресцентную) и тем самым в тысячи раз повысить скорость секвенирования ДНК.
Получение Н.к. В клетках Н.к. связаны с белками, образуя нуклеопротеиды. Выделение Н.к. сводится преим. к очистке их от белков. Для этого препараты, содержащие Н.к., обрабатывают ПАВ и экстрагируют белки фенолом. Послед, очистка и фракционирование Н.к. проводятся с помощью ультрацентрифугирования, разл. видов жидкостной хроматографии и гельэлектрофореза. Для получения индивидуальных Н.к. обычно используют разл. варианты последнего метода.
Совр. методы хим. синтеза Н.к. позволяют получать крупные фрагменты ДНК, в т. ч. целые гены. Методич. основы хим.-ферментативных методов синтеза ДНК разработаны Х. Кораной. Они включают: 1) хим. синтез комплементарных, взаимоперекрывающихся олигонуклеотидов, из которых затем в результате комплементационных взаимод. выстраиваются дуплексы — фрагменты молекулы синтезируемой ДНК с несовпадающими разрывами в обеих цепях; 2) соединение (лигирование) таких олигонуклеотидов в составе дуплекса с помощью фермента Т4 ДНК-лигазы. Сборку протяженных ДНК из синтетич. однотяжевых олигонуклеотидов проводят в неск. этапов (рис. 4). Сначала (а) собирают небольшие дуплексы с "липкими" концами (однотяжевыми комплементарными участками), из которых затем последовательно (б, в и т. д.) формируют более протяженные структуры. Т. обр. могут быть получены искусств. фрагменты ДНК большой длины и с любой нуклеотидной последовательностью. С помощью генетич. инженерии возможно клонирование (получение в индивидуальном виде и размножение) искусств. ДНК.
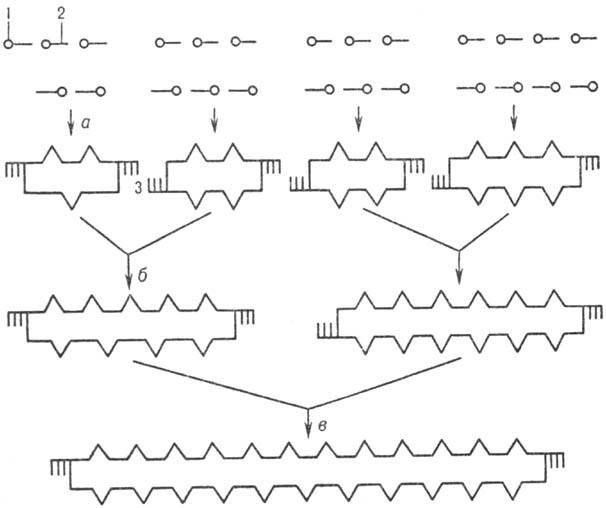
Рис.4. Схема синтеза полидезоксинуклеотида: 1,- соотв. 5'- и 3'-конец олигонуклеотидов; 3 — комплементарные участки концов дуплексов (:липкие: концы); а,б и в — стадии образования дуплексов (все стадии катализируются Т4 ДНК-лигазой).
Синтез олигодезоксинуклеотидов Корана осуществил т. наз. фосфодиэфирным методом по схеме:
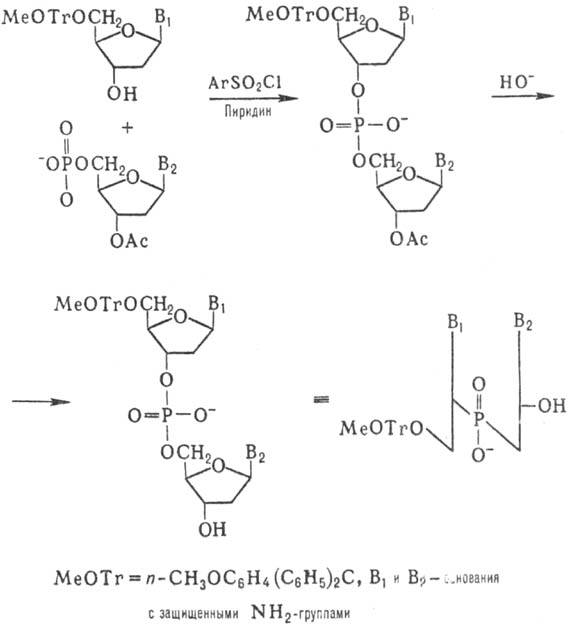
К динуклеотиду со своб. 3'-гидроксильной группой присоединяют таким же способом динуклеотид с незащищенной 5'-фосфатной группой и т. д. (т. наз. блочный метод синтеза):
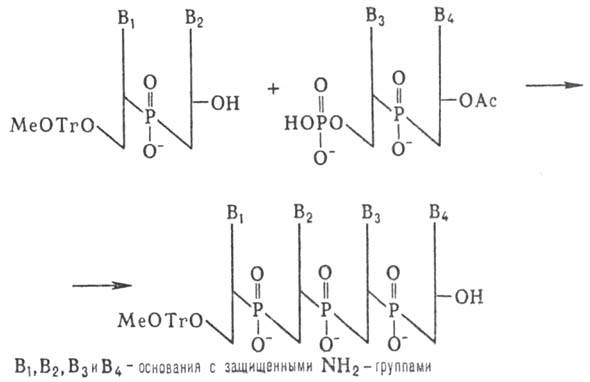
Несмотря на малую эффективность этого метода, были синтезированы олигонуклеотиды, содержащие до 16 звеньев, из которых были собраны первые синтетич. гены. Фосфодиэфирный метод образования межнуклеотидных связей, использованный Кораной, имеет история, значение. Однако разработанные им приемы введения и избират. удаления защитных групп широко используются в др. методах синтеза Н.к.
Важным шагом в совершенствовании синтеза олигонуклеотидов явилась разработка т. наз. фосфотриэфирного метода, который осуществляют по схеме:
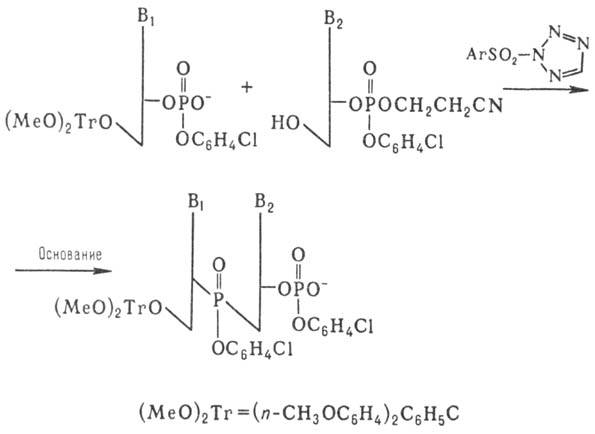
Образующийся динуклеотид далее (после частичного деблокирования фосфата) конденсируют аналогичным образом с др. динуклеотидом и т. д. Применение этого способа, в котором используют защиту фосфатной группы, позволило значит. сократить время синтеза и повысить выходы олиго-нуклеотидов.
Параллельно этим методам, которые осуществляют в растворах, разрабатывались твердофазные способы синтеза Н.к. В последнем случае процесс проводят в двухфазной системе; нуклеозидный компонент связан ковалентно с нерастворимым полимером, а нуклеотидный компонент и необходимые реагенты находятся в растворе.
Обычно в этом случае на первой стадии нуклеозид присоединяют с помощью "якорной" группы к нерастворимому полимеру. Затем его 5'-гидроксильную группу деблокируют и конденсируют с нуклеотидным компонентом. У образующегося полностью защищенного динуклеозидмонофосфата деблокируют защитную группу в положении 5' и присоединяют след. нуклеотид и т. д.
Наиболее распространенные методы твердофазного синтеза олигонуклеотидов основаны на использовании нуклеотидного компонента, содержащего Р(III). В т. наз. амидофосфитном-способе (рис. 5) нуклеотидным компонентом является эфир 3'-амидофосфита дезоксинуклеозида. Достаточно устойчивые амидофосфиты при протонировании в присутствии тетразола превращ. в сильные фосфорилирующие агенты. Схема также включает блокирование непрореагировавшей 3'-гидроксигруппы достраивающегося олигонуклеотида (кэпирование) и окисление межнуклеотидного фосфита. На рис. показан один цикл наращивания цепи, который длится 5–7 мин и далее повторяется. После завершения синтеза удаляют защитные группы с межнуклеотидных фосфатов, отделяют олигонуклеотид от носителя, деблокируют группы NH2 гетероциклов. Липофильную группу (МеО)2Тr удаляют после первого хроматографич. разделения.
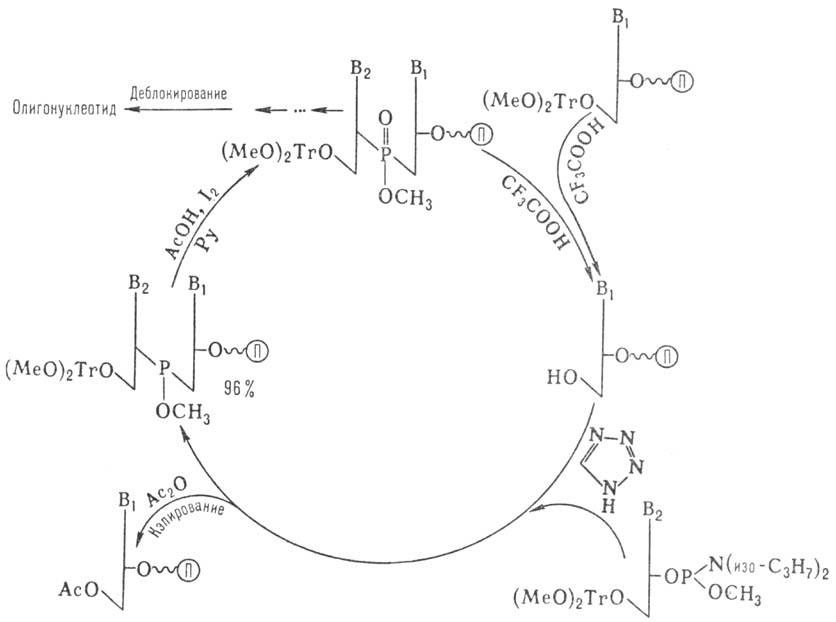
Рис. 5. Схема твердофазного синтеза олигонуклеотидов амидофосфитным методом; П — полимерный носитель, Рупиридин.
Др. метод основан на использовании гидрофосфорильного производного нуклеозида:
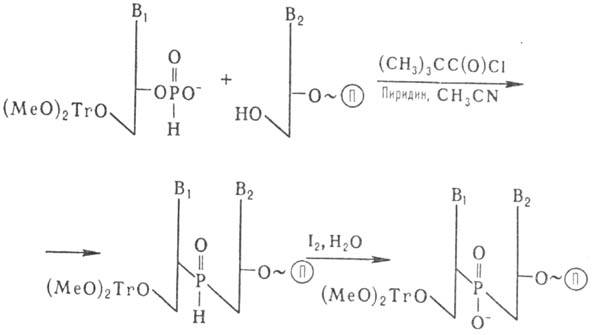
П-полимерный носитель
После снятия 5'-защитной диметокситритильной группы возможно присоединение след. нуклеотида. Окисление межнуклеотидных фосфитных групп проводят после завершения синтеза олигонуклеотида.
Стандартность операций в твердофазном синтезе олиго-нуклеотидов явилась основой для автоматизации процесса. Принцип работы автомата-синтезатора основан на подаче в реактор с помощью насоса (под контролем микропроцессора) защищенных нуклеотидных компонентов реагентов и растворителей по заданной программе в колонку, содержащую полимерный носитель с закрепленным на нем первым нуклеозидом. После окончания синтеза и отделения полностью защищенного олигонуклеотида от полимерного носителя проводят деблокирование, очистку и анализ синтезир. фрагментов ДНК. Так, с помощью гидрофосфорильного метода в автомате-синтезаторе за неск. часов получают 30-40-звенные олигонуклеотиды; возможен синтез более чем 100-звенных фрагментов ДНК. Разработаны синтезаторы, позволяющие проводить одновременно синтез неск. олигонуклеотидов.
Синтез олигорибонуклеотидов ферментативным путем осуществляют обычно с использованием рибонуклеаз (РНаз) или полинуклеотидфосфорилаз (ПНФаз). В первом случае реакцию осуществляют по схеме:
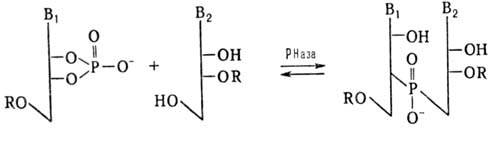
R-H или остаток олигорибонуклеотида
В качестве нуклеотидного и нуклеозидного компонентов применяют мономеры или олигонуклеотиды. Эту реакцию используют для синтеза ди-, три- и тетрарибонуклеотидов. При увеличении длины олигорибонуклеотида начинает преобладать обратная реакция (гидролиз олигонуклеотида).
Для синтеза олигорибонуклеотидов с большим числом звеньев используют ПН Фазу:
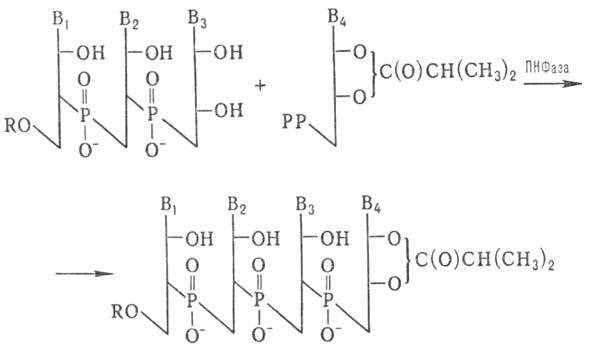
РР — Остаток пирофосфорной кислоты
Хим. синтез олигорибонуклеотидов проводят в осн. с использованием тех же приемов, как и при синтезе ДНК. Дополнит. трудности связаны с селективной защитой 2'-гидроксигруппы рибозы, а также с неустойчивостью фосфодиэфирной связи РНК в щелочной среде.
Длинные фрагменты РНК получают из коротких, соединяя их с помощью РНК-лигазы.
Историческая справка. Н.к. открыты в 1869–72 Ф. Мишером в ядрах (отсюда назв.: лат. nucleus-ядро) клеток гноя и в сперме лосося. В 1889 Р. Альтман выделил их в чистом виде (им же предложен термин "Н.к."). В 1944 О. Эйвери показал, что с помощью ДНК наследств. признаки м. б. переданы от одной клетки к другой и что ДНК, т. обр., является "веществом наследственности". Хим. строение Н.к. изучалось школами А. Косселя, П. Левина, Дж. Гулленда и А. Тодда и было окончательно установлено к нач. 50-х гг. Макромол. структура ДНК (двойная спираль) установлена в 1953 Дж. Уотсоном и Ф. Криком на основании данных рентгеноструктурного анализа, полученных Р. Франклин и М. Уилкинсом. Нуклеотидный состав ДНК и РНК из многих объектов изучен Э. Чаргаффом и А. Н. Белозерским в 40-50-х гг. Изучение первичной структуры Н. к. начато с сер. 60-х гг. с установления нуклеотидной последовательности тРНК (Р. Холли). Функции большинства РНК установлены к нач. 60-х гг. Было показано, что они участвуют в реализации генетич. информации, закодированной в ДНК.
П. Доти и А. С. Спириным исследовано макромол. строение РНК. В сер. 70-х гг. разработаны эффективные методы расшифровки первичной структуры ДНК и РНК (методы Максама — Гилберта и Сенгера), которые в сочетании с методами генетич. инженерии позволили в течение след. десятилетия определить нуклеотидные последовательности мн. генов, плазмид, вирусных ДНК и РНК, рРНК и др. Разработаны приемы обработки этой информации с использованием ЭВМ. В 70-х гг. Кораной разработаны методы синтеза ДНК; им впервые синтезированы прир. гены (аланиновой и тиразиновой транспортных РНК). Начиная с сер. 70-х гг. создавались методы получения рекомбинантных Н.к. (образуются, напр., в результате встраивания участка ДНК, в т. ч. гена, в плазмиду; см. генетическая инженерия), которые существенно расширили возможности структурно-функцион. исследований Н.к. и создали базу для использования достижений мол. биологии и генетики в биотехнологии. В 80-е гг. разработаны эффективные методы химического (в т. ч. автоматического) синтеза олигонуклеотидов и крупных фрагментов ДНК, которые широко используют для изучения структуры и функций Н.к.
Лит.: Шабарова 3. А., Богданов А. А., Химия нуклеиновых кислот и их компонентов, М., 1978; Страйер Л., Биохимия, пер. с англ., т. 3, М., 1985; Уотсон Дж., Туз Дж., Курц Д., Рекомбинантные ДНК, пер. с англ., М., 1986; Зенгер В., Принципы структурной организации нуклеиновых кислот, пер. с англ., М., 1987; Овчинников Ю.А., Биоорганическая химия, М., 1987, с. 295–397.
А. А. Богданов, З. А. Шабарова
Значения в других словарях
- Нуклеиновые кислоты — Полинуклеотиды, важнейшие биологически активные Биополимеры, имеющие универсальное распространение в живой природе. Содержатся в каждой клетке всех организмов. Н. к. были открыты в 1868 швейцарским учёным... Большая советская энциклопедия
- нуклеиновые кислоты — НУКЛЕИНОВЫЕ КИСЛОТЫ, полинуклеотиды, высокомолекулярные соединения, содержащиеся во всех живых клетках, состоящие из большого числа нуклеотидов. Ветеринарный энциклопедический словарь
- нуклеиновые кислоты — НУКЛЕИНОВЫЕ КИСЛОТЫ, полинуклеотиды, высокомолекулярные фосфорсодержащие органич. соединения, обнаруженные во всех живых клетках и выполняющие важнейшую биол. функцию по хранению, реализации и передаче генетич. информации. Молекулы Н. Сельскохозяйственный словарь
- нуклеиновые кислоты — НУКЛЕИНОВЫЕ КИСЛОТЫ — высокомолекулярные соединения, представляющие собой продукты полимеризации большого числа нуклеотидов. Имеют большое значение в жизни всех организмов и играют существенную роль в явлениях наследственности... Ботаника. Словарь терминов
- Нуклеиновые кислоты — Дезоксирибонуклеиновые и рибонуклеиновые кислоты, универсальные компоненты всех живых организмов, ответственные за хранение, передачу и воспроизведение (реализацию) генетической информации. На два типа все Н. Медицинская энциклопедия
- нуклеиновые кислоты — Полинуклеотиды, фосфорсодержащие биополимеры, имеющие универсальное распространение в живой природе. Впервые обнаружены Ф. Мишером в 1868 в клетках, богатых ядерным материалом (лейкоцитах, сперматозоидах лосося). Термин «Н. к.» предложен в 1889. Биологический энциклопедический словарь
- НУКЛЕИНОВЫЕ КИСЛОТЫ — НУКЛЕИНОВЫЕ КИСЛОТЫ, химические макромолекулы, присутствующие во всех живых организмах и в вирусах. Существует два типа нуклеиновых кислот: ДНК (дезоксирибонуклеиновая) хранит ГЕНЕТИЧЕСКИЙ КОД... Научно-технический словарь
- нуклеиновые кислоты — (полинуклеотиды), биополимеры, содержащиеся во всех живых клетках и в вирусах. Впервые были обнаружены и выделены из клеток швейцарским биохимиком И.Ф. Мишером в 1868 г. Но только в сер. Биология. Современная энциклопедия
- НУКЛЕИНОВЫЕ КИСЛОТЫ — НУКЛЕИНОВЫЕ КИСЛОТЫ (полинуклеотиды) — высокомолекулярные органические соединения, образованные остатками нуклеотидов. В зависимости от того, какой углевод входит в состав нуклеиновой кислоты — дезоксирибоза или рибоза... Большой энциклопедический словарь
