метиловый спирт
МЕТИЛОВЫЙ СПИРТ (метанол, карбинол, древесный спирт) CH3OH
мол. м. 32,04. Длина связей (им): 1,4214 b b0,0017 (C—O), 1,0937 b0,0028 (С—Н), 0,9630 b 0,0079 (О—Н); валентные углы: 108°32'b8' (НСН), 108°02'b24' (СОН); угол 9 (между осью симметрии группы CH3 и направлением связи C—O) 3°16'b18'.
М. с. — бесцв., легкоподвижная жидкость с запахом, аналогичным запаху этилового спирта; т. пл. −93,9 °C, т. кип. 64,509 °C; d204 0,7914; nD20 1,3286; h 0,584 МПа∙с (20 °C), давление паров (кПа): 11,8 (20 °C), 32,5 (40 °C), 77,3 (60 °C), 320,65 (100 °C); g 22,55 мН/м (20 °C), 21,69 мН/м (30 °C); tкрит 240,1 °C, pкрит 7,977 МПа, dкрит272 кг/м3; μ 0,57∙10−30 Кл∙м; e 32,63 (25 °C); ΔH0обр −238,9 кДж/моль (жидкость), −201,0 b b0,6кДж/моль (газ), ΔH0сгор, −715 кДж/моль, ΔH0исп 37,9 b 0,2 кДж/моль, ΔHпл 3,17 кДж/моль; теплопроводность 202,3∙10−3 Вт/(м∙К) (жидкость), 150,7∙10−4 Вт/(м∙К) (газ); С0р 44,129 Дж/(моль∙К). Теплоемкость для температур 0–50 °C определяют по уравнению Cр = 2,3815 + 0,0586∙t [кДж/(кг∙К)], в газообразном состоянии для температур 0–1200 °C-по уравнению Cр = 25,0429 + 50,3249∙10−3T+ 59,1298∙10−6 Т2-45,245∙10−9 Т3 [кДж/(моль∙К)].
СВОЙСТВА ВОДНЫХ РАСТВОРОВ МЕТИЛОВОГО СПИРТА В ЗАВИСИМОСТИ ОТ ЕГО КОНЦЕНТРАЦИИ
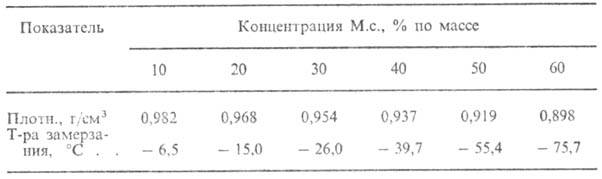
М.с. смешивается во всех соотношениях с водой (свойства водных растворов М.с. приведены в табл.), спиртами, ацетоном, бензолом; образует азеотропные смеси с ацетоном (т. кип. 55,7 °C; 12% М.с.), бензолом (т. кип. 57,5 °C; 39% М.с.), CS2 (т. кип. 37,65 °C; 14% М.с.), CCl4 (т. кип. 55,7 °C; 20,66 % М.с.) и мн. др. соединениями.
По химическим свойствам М. с. — типичный одноатомный алифатич. спирт: сочетает свойства очень слабого основания и еще более слабой кислоты. С щелочными металлами образует метилаты, напр. CH3ONa, с кислотами — сложные эфиры (реакция ускоряется в присутствии сильных минер. кислот), напр. с HNO2 дает метил-нитрит CH3ONO (количественно), с H2SO4 при температуре ниже 100 °C-метилсульфат CH3OSO2OH, с карбоновыми кислотами-RCOOCH3. Окисляется кислородом воздуха (кат. — Ag, Cu, оксиды Fe, Mo, V и др.) при 500–600 °C до формальдегида: CH3OH + 0,5O2 → HCHO + H2O; при пропускании паров М.с. над медьсодержащим кат. образуется метилформиат: 2CH3OH → НCOOCH3 + 2H2. Последний получается также при взаимодействии М.с. и CO в присутствии метилатов щелочных металлов, а в присутствии родиевого кат. и CH3I они дают уксусную кислоту. При взаимодействии со смесью CO и H2 М. с. превращается в этанол и др. спирты. Он разлагается водяным паром на катализаторе: CH3OH + H2O → ЗH2 + CO2. После очистки от CO2 получают H2 98%-ной чистоты. Таким способом производят H2 в передвижных установках небольшой мощности.
При взаимодействии с NH3 в присутствии дегидратирующих катализаторов М.с. образует метиламины:
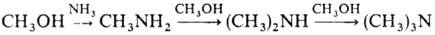
Аррматич. амины метилируются М. с. в присутствии H2SO4 (200 °C; 3 МПа): C6H5NH2 + 2CH3OH → C6H5N(CH3)2+ + 2H2O. При 3,5 МПа и 340–380 °C он реагирует с бензолом, образуя толуол. Дегидратацией М.с. при повышенных температурах (кат. — Al2O3) получают диметиловый эфир: 2CH3OH → CH3OCH3 + H2O. На высококремнистых цеолитах при 340–450 °C М.с. превращается в парафины и ароматические углеводороды. С галогеноводородными кислотами, SO2Cl2 или POCl3 образует метилгалогениды. Взаимод. М. с. с иодом и фосфором в промышленности получают метилиодид: 10CH3OH + 5I2 + 2Р → 10CH3I + 2H3PO4 + 2H2O. При повышенных температурах на катализаторе М. с. разлагается на CO и H2.
В промышленности М.с. получают гл. обр. каталитич. реакцией из синтез-газа: CO2 + ЗH2 ⇄ CH3OH + H2O + 49,53 кДж; образующаяся вода вступает в реакцию: H2O + СО ⇄ CO2 + H2 + 41,2 кДж. Константа равновесия образования М.с. из CO2 и H2 с учетом ассоциации паров м. б. рассчитана по уравнению.
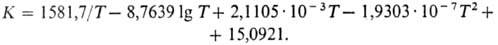
Сырьем для производства М.с. служат гл. обр. прир. газ и отходы нефтепереработки (см., напр., газификация нефтяных остатков), а также коксующийся уголь (см. газификация твёрдых топлив), газы производства ацетилена пиролизом прир. газа и др. До 1960-х гг. М.с. синтезировали только на цинкхромовом кат. при 300–400 °C и давлении 25–40 МПа. Впоследствии распространение получил синтез М.с. на медьсодержащих кат. (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200–300 °C и давлении 4–15 МПа.
Совр. технол. схема производства М. с. из прир. газа включает след. осн. стадии. 1) Очистку прир. газа от соед. серы гидрироваиием их до H2S, который затем адсорбируют поглотителем-ZnO. 2) Конверсию прир. газа в синтез-газ — в осн. паровую или пароуглекислотную, а также парокислородную или парокислородноуглекислотную. После охлаждения и конденсации водяных паров газ компримируют.
3) Синтез М. с. Газ, выходящий из реактора, содержит 3–5% М.с. После охлаждения и конденсации продуктов реакции оставшийся газ смешивают с исходным газом и вновь подают в реактор. Метанол-сырец содержит кроме метанола (94–99% в зависимости от катализатора и условий реакции) воду, пропанол, бутиловые и амиловые спирты, диметиловый эфир и др. вещества, образующиеся в реакции.
4) Ректификацию метанола-сырца: на первой ступени отгоняют легко летучие компоненты, на второй М.с. отделяют от воды и высококипящих компонентов. Товарный М.с. содержит обычно 0,08–0,02% воды. В совр. технол. схемах производства М.с. используются вторичные энергоресурсы.
Применяют М. с. гл. обр. для производства формальдегида; его используют также для получения метилметакрилата, метиламинов, диметилтерефталата, метилформиата, метилхлорида, уксусной кислоты, лек. веществ и др., как добавку к бензину (М. с. обладает высоким октановым числом) и для получения бензина в целях экономии нефтяного сырья. Разрабатываются процессы получения из М.с. уксусного ангидрида, винилацетата, этанола, ацетальдегида, этиленгликоля и др. многотоннажных нефтехим. продуктов.
Т. всп. 15,6 °C (в открытой чашке), т. самовоспл. 464 °C, КПВ 6,70–36,5%. М. с. — сильный, преим. нервный и сосудистый яд с резко выраженным кумулятивным действием; отравление наступает при приеме внутрь (смертельная доза для человека 30 г, а 5–10 г могут вызвать тяжелое отравление), вдыхании паров и проникновении через кожу. ПДК 5 мг/м3.
Мировое производство ок. 14 млн. т/год (1983).
Впервые М.с. был выделен из продуктов сухой перегонки древесины Ж. Дюма и Э. Пелиго, которые, сопоставив его свойства со свойствами винного спирта, дали первые представления о классе спиртов (1835). В 1857 М. Бертло синтезировал М.с. омылением метилхлорида. Синтетич. М.с. начали получать с 1923.
Лит.: Караваев М. М., Мастеров А. П., Производство метанола, М., 1973; Розовский А. Я., "Кинетика и катализ", 1980, т. 21, в. 1, с. 97–107; Кузнецов В. Д. [и др.], "Теоретические основы химической технологии", 1977, т. 11, №6, с. 866–71; Островский В. Е., Дятлов А. А., "Докл. АН СССР" 1982, т. 264, № 2, с. 363–67; Леонов В. Е., Лободин С. С., "Ж. Всес. хим. общества им. Д.И.Менделеева", 1984, т. 29, №4, с. 414–23; Розовский А. Я., Лин Г. И., Теоретические основы процесса синтеза метанола, М., 1990.
Ю. В. Лендер
Значения в других словарях
- Метиловый спирт — Метанол, древесный спирт, CH3OH, бесцветная жидкость с запахом, подобным запаху этилового спирта; tкип 64,5 °С, плотность 0,7924 г/см3 (20 °С). С воздухом в объёмных концентрациях 6,72—36,5% М. с. образует взрывоопасные смеси; температура вспышки 15,6 °С. Большая советская энциклопедия
- МЕТИЛОВЫЙ СПИРТ — МЕТИЛОВЫЙ СПИРТ, см. МЕТАНОЛ. Научно-технический словарь
- Метиловый спирт — См. Мета- Медицинская энциклопедия
- Метиловый спирт — СН4О — представляет собой простейший из алкоголей CH3.OH. М. спирт в свободном состоянии встречается в соке некоторых растений (Гутцейт и Макенн) и в водном дистилляте плодов Heracleum'a (Гутцейт). Энциклопедический словарь Брокгауза и Ефрона
- МЕТИЛОВЫЙ СПИРТ — МЕТИЛОВЫЙ СПИРТ (метанол — древесный спирт) — CH3OH, бесцветная жидкость со слабым спиртовым запахом, tкип 64,5 °С. Сырье в производстве формальдегида, сложных эфиров, напр. диметилтерефталата, и др. продуктов; растворитель. Большой энциклопедический словарь
