кюрий
КЮРИЙ (от имени П. Кюри и М. Склодовской-Кюри; лат. Curium) Cm
искусственный радиоактивный хим. элемент III гр. периодической системы, ат. н. 96; относится к актиноидам. Стабильных изотопов не имеет. Известно 15 изотопов с мас. ч. 237–251. Наиб. долгоживущие изотопы 247Сm (T1/2 1,58∙107 лет) и 248Сm(Т1/2 3,4∙105 лет)-α-излучатели. Первый из них обнаружен в земной коре в некоторых радиоактивных минералах; родоначальник семейства 235U. Конфигурация внеш. электронных оболочек атома 5f7б526p66d17s2; степень окисления +3 (наиб. устойчива), +4, +6; электроотрицатсльность по Полингу 1,2; ат. радиус 0,175 нм, ионные радиусы 0,0946 нм для Cm3+ и 0,0886 нм для Cm4+ Свойства. К. — мягкий серебристо-белый металл; светится в темноте под действием собственного α-излучения. При обычной температуре устойчива модификация с гексагои. решеткой типа α-La (а=0,3496 нм, с=1,1331 нм), выше 1277 °C — с кубич. гранецснтрированной (а=0,4382 нм), ΔH0 перехода 3,ЗкДж/моль. Для К. т. пл. 1358 °C, т. кип. 3110 °C; рентгеновская плотн. 13,51 г/см3; C0p 27 Дж/(моль∙К); ΔH0пл 14 кДж/моль; S0298 71 Дж/(моль∙К); уравнение температурной зависимости давления пара: lgp( мм рт. ст.)=(4,74b0,37)-(18060b690)/T (1170–2068 К); ферромагнетик с точкой Кюри 131 К. По химическим свойствам К. во многом подобен лантаноидам и Am. С разб. кислотами образует соли Cm3+, с H2 при 200–250 °C — CmH2+x. При прокаливании Сm2(C2O4)3 или Сm(OH)3 на воздухе или в токе O3 либо O2 при 650 °C получают диоксид СmO2 (см. табл.). При нагр. СmO2 в высоком вакууме или в атмосфере H2 получают сесквиоксид Ст2O3 с т. пл. 2270 °C: при 600 °C образуется кубич. модификация, при 900 °C — моноклинная, при 1615 °C — гексагональная. Известны галогениды Cm(III), а также высшие фториды. Трифторид CmF3 (т. пл. 1410 °C, плотн. 9,7 г/см3) получают действием газообразного HF на СmO2 при 400–450 °C или осаждением фтористоводородной кислотой из водного раствора в виде гидрата с послед. обезвоживанием над P2O5. Тетрафторид CmF4 получают фторированием CmF3 фтором при 400 °C. Известны комплексные фториды и летучий CmF6. Трихлорид СmCl3 (плотн. 5,81 г/см3.
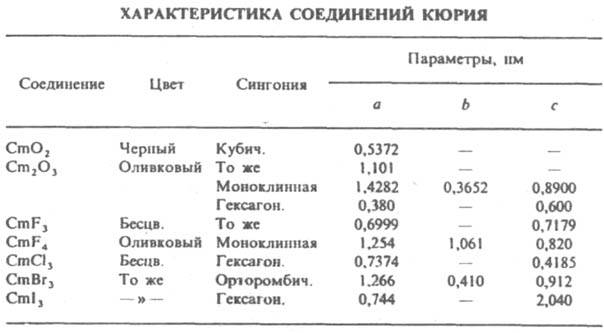
ΔH0обр −970 кДж/моль) получают взаимод. газообразного HCl с СтO2 при 400 500 °C В паровой фазе СmCl3 гидролизустся до оксихлорида CmOCl. Трибромид СmBrэ и трииодид Сml3 получают из СmCl3 при действии соотв. МH4Br или NH4I в токе H2 при 400 450 °C. Известен также оксибромид CmOBr. Водные растворы Cm(III) бесцветны, конц. растворы — желтоватые, светятся бледно-голубым цветом в темноте. Стандартные окислит. потенциалы +3,18 В для Cm(IV)/Cm(III), +1,53 В для Cm(VI)/Cm(V); ΔH0обр иона Cm3+ для бесконечно разб. раствора −611 кДж/моль. При окислении Cm3+ персульфатом калия при нагр. в присутствии ненасыщ. гетерополианионов образуется неустойчивый Cm4+; Cm6+ (в виде СтO22+) получен при β-распаде 242АmO2+ в твердом K3АmO2(CO3)2.
Получение. Изотопы К. образуются при облучении Pu и Am в ядерных реакторах. 242Сm в больших количествах с малой примесью др. изотопов К. получают при облучении 241Am тепловыми нейтронами. При облучении Pu и 243Аm образуется смесь изотопов К. с мас. ч. 244–248; при малом интегральном потоке нейтронов получают сравнительно чистый 244Сm, а при очень большом — 248Сm. Миллиграммовые количества 248Сm можно выделить из старых образцов 252Сf Для выделения изотопов К. используют экстракцию, сорбцию и осаждение. Металлич. К. получают восстановлением CmF3 парами Ba при 1275 °C или СmO2 сплавом Mg-Zn в присутствии флюса MgCl2-MgF2 при 900 °C. Изотопы 242Сm (Т1/2 162,5 сут) и 24Cm (Т1/2 18,1 лет) используют в изотопных источниках тока (1 г 242Сm выделяет 120 Вт тепловой энергии), для получения транскюриевых элементов, чистого 238 Pu. К. высокотоксичен; ПДК изотопов 242Сm и 244Сm в водоемах соотв. 44,4 и 14,4 Бк/л, в воздухе рабочих помещений 2,2∙10−4 и 1,7∙10−7 Бк/л. Впервые К. получен Г. Сиборгом, Р. Джеймсом и А. Гиорсо в 1944 при облучении 239Pu ускоренными α-частицами. Первое чистое соед. К. выделено Л. Вернером и И. Пёрлменом в 1947, металлич. К. получен Дж. Уолменом и др. в 1951.
Лит. см. при ст. актиноиды.
Б. Ф. Мясоедов
Значения в других словарях
- кюрий — Кю́р/ий/. Морфемно-орфографический словарь
- Кюрий — (лат. Curium) Cm, искусственно полученный радиоактивный химический элемент семейства актиноидов (См. Актиноиды), атомный номер 96. Стабильных изотопов не имеет. Впервые получен в 1944 американским учёными Г. Сиборгом, Р. Джеймсом... Большая советская энциклопедия
- кюрий — орф. кюрий, -я (хим.) Орфографический словарь Лопатина
- кюрий — КЮРИЙ я, м. curium. По имени фр. физиков П. Кюри и М. Склодовской-Кюри. Полученный искусственно радиоактивный химический элемент; отн. к а ктиноидам; серебристый металл. Крысин 1998. — Лекс. БАС-1: кюрий. Словарь галлицизмов русского языка
- КЮРИЙ — КЮРИЙ, (символ Cm), синтетический радиоактивный металл, элемент ряда АКТИНИДОВ. Он был впервые получен в 1944 г. Гленом СИБОРГОМ и его сотрудниками путем бомбардирования плутония-239 альфа-частицами в ускорителе-циклотроне. Научно-технический словарь
- кюрий — КЮРИЙ -я; м. [лат. Curium] Химический элемент (Cm), полученный искусственно, — радиоактивный металл серебристого цвета, относящийся к актиноидам (применяется в ядерной физике). ● Назван по имени основателей науки о радиоактивности французских физиков... Толковый словарь Кузнецова
- КЮРИЙ — КЮРИЙ (лат. Curium) — Cm, химический элемент III группы периодической системы, атомный номер 96, относится к актиноидам. Радиоактивен, наиболее устойчивый изотоп 247Cm (период полураспада более 1,58 • 107 лет). Назван в честь П. Кюри... Большой энциклопедический словарь
- кюрий — кюрий м. Искусственно полученный радиоактивный химический элемент. Толковый словарь Ефремовой
