иридийорганические соединения
ИРИДИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат связь Ir—С. В химических свойствах И. с. наблюдаются сходства и различия со свойствами кобальт- и родийорг. соединений. Степени окисления Ir в И. с. от −1 до + 5, координац. числа обычно 4–7. Связи металл — углерод, как правило, более прочны, чем в соед. Со и Rh, что приводит к большей устойчивости И. с. Переходы между соед. Ir, отличающимися степенями окисления, координац. числами Ir и (или) природой лигандов, относительно затруднены: по этой причине И. с. не находят такого широкого применения в катализе, как орг. соед. Со и Rh. Для Ir, особенно в степени окисления +3, весьма характерны соед. с одной или двумя σ-связями Ir—С, входящими в четырех- или пятичленный хелатный цикл, как, напр., в соед. I. Наиб. важные И.с. — соед. Ir(I) и Ir(Ш). Соед. Ir(I) с σ-связью Ir—С получают обычными методами металлоорг. химии, напр., присоединением к олефинам соед. со связями Ir1—Н, действием литийорг. соед. на комплекс Васка (транс-[Ir(CO)(PPh3)2Cl]) и его аналоги: транс-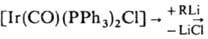 , транс-[Ir(CO)(PPh3)2R], где R — алкил, арил. Для получения соед. Ir(III) с σ-связью Ir—С наряду с обычными методами металлоорг. химии используют реакции окислит. присоединения к соед. Ir(I) — межмолекулярные и внутримолекулярные (циклометаллирование), напр.:
, транс-[Ir(CO)(PPh3)2R], где R — алкил, арил. Для получения соед. Ir(III) с σ-связью Ir—С наряду с обычными методами металлоорг. химии используют реакции окислит. присоединения к соед. Ir(I) — межмолекулярные и внутримолекулярные (циклометаллирование), напр.:
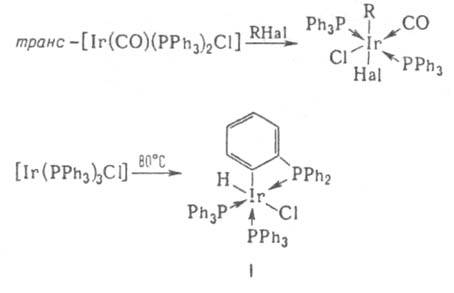
Комплекс Васка (т. пл. 323–325 °C) получают взаимод. IrCl3 или (NH4)2[IrCl6] с PPh3 в 2-(2-метоксиэтокси)этаноле или ДМФА. Некоторые π-комплексы Ir образуются в результате присоединения непредельных соед. к координационно ненасыщенным комплексам, напр., олефинов к комплексу Васка: транс-[Ir(СО)(РРh3)2Cl] + C2H4 → [Ir(CO)(PPh3)2(C2H4)Cl]. Эти реакции обычно обратимы. Часто используют также замещение лигандов, осуществляемое в случае анионных лигандов в восстановит. условиях (напр., замещение остатка ацетилацетона проводят в присутствии алюминийорг. соединений). Орг. соединения Ir(V) содержат в качестве лигандов η-C5(CH3)5, а также др. лиганды, являющиеся сильными донорами, напр., в соед. [Ir{η-C5(CH3)5}(CH3)4]. Несмотря на высокую степень окисления Ir, эти соед. не являются типичными окислителями, для них скорее характерны реакции восстановит. элиминирования и разложения под действием электрофилов, приводящие к понижению степени окисления и координац. числа. В некоторых случаях даже образуется металлич. иридий.
Лит.: Leigh G.J., Richards R. L., в кн.: Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 5, Oxf., 1982; Dickson R.S., Organometallic chemistry of rhodium and iridium, N.Y., 1983.
И. Я. Левитин
